БИОХИМИЯ
УДК 599.332.72.616
Г. Р. Агамян
Воздействие пролин-богатого полипептида на эндогенный
уровень металлопротеинов анти- и прооксидантной активности
в тканях белых
крыс
(Представлено академиком К. Г. Карагезяном 15 /IX 2006)
Ключевые слова: пролин-богатый полипептид, металлопротеины, ткань
Воздействие синтетического аналога
пролин-богатого полипептида -1 (ПБП-1) на различного характера биосистемы
интенсивно исследуется уже больше 15 лет. Эти исследования показали, что ПБП-1
обладает антимикробиальным, иммунномодуляторным, нейропротективным и
кардиопротективным эффектами [1,2]. При повышенных концентрациях (больше 80 мкг)
ПБП-1 обладает способностью стимулировать процесс продуцирования гидроксильных
радикалов (HO.) [3], однако по предварительным результатам при
относительно низких концентрациях (0.1-5 мкг), наоборот, обладает способностью
улавливать гидроксильные радикалы, оказывая антиоксидантный эффект. Таким
образом ПБП-1 защищает многие металлопротеины, которые денатypируются
гидроксильными радикалами, например, некоторые металлопротеины антиоксидантной
(МАА) и прооксидантной (МПА) активности, оказывая антистрессорный эффект при
различного характера проявлениях оксидативного стресса, особенно в тех случаях,
когда наблюдается повышение уровня перекиси водорода в различных формированиях
тканей. Эти явления наблюдаются при канцерогенезе, алюминиевой интоксикации,
интоксикации тяжелыми металлами, гипогликемии, гемосекции спинного мозга [4-8].
ПБП-1 стабилизирует и эритроцитарные мембраны (ЭМ), подавляя процесс рилизинга
изоформ цитохрома (цит)b 558 из их мембран [9]. Однако механизмы воздействия
ПБП-1 на уровень МАА и МПА в тканях здоровых крыс в отсутствии оксидативного
стресса комплексно еще не определены.
Цель
работы состоит в определении воздействия экзогенно введенного ПБП-1 на уровень
МАА и МПА в крови и других тканях здоровых крыс под влиянием экзогенно
введенного ПБП-1.
Белым половозрелым здоровым
крысам (12 животных) массой 200-250 г внутрибрюшинно было введено по 10 мкг/ мл
ПБП-1 всего три раза через каждые двое суток. Контрольным животным был введен
физиологический раствор в аналогичном режиме (по 0.5 мл). Крысы были
декапитированы под легким эфирным наркозом. Кровь стабилизировали 2%-ным
оксалатом натрия в условиях легкого перемешивания в ходе набора крови. Кровь
животных опытной и контрольной групп (по 35 мл) была далее инкубирована в
аэробных условиях in vitro при 4o в течение 4 суток. Это делается для
синтеза in vitro сывороточных цит b558 как новых и важных компонентов защиты
крови от повреждающих эффектов перекиси водорода.
МАА (Cu, Zn-СОД и каталаза из растворимой фракции эритроцитов,
церулоплазмин (ЦП) и трансферрин (ТФ) из сыворотки крови) и МПА (цит b5 из
растворимой фракции эритроцитов, изоформы цит b558 ЭМ - цит b558III и цит
b558IV, цит b558 нейтрального характера,
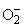 -продуцирующий липопротеин сыворотки - супрол)
выделяли и очищали биотехнологическим способом путем ионообменной хроматографии
белковых фракций сыворотки, растворимой части эритроцитов и ЭМ на целлюлозах
ДЕ-52 и КМ-52 ("Whatman", Англия), сефадексе ДЕАЕ А-50 ("Pharmacia", Швеция) и
гель-фильтрации на сефадексах G-100 и G-150 (Pharmacia). Цит b558III и цит
b558IV выделяли и очищали без использования детергента, заметно снижающего
стабильность указанных гемопротеинов [10,11]. Количество МП определяли путем
измерения характерной для данного белка плотности максимального оптического
поглощения: для цит b5 - 525, изоформ цит b558 - 530, супрола - 430, ЦП - 610 и
ТФ - 470 нм. Активность cупероксиддисмутазы определяли общеизвестным методом
нитротетразолиевого синего (НТС), путем измерения процента ингибирования
образования формазана в результате восстановления НТС супероксидными
радикалами.
-продуцирующий липопротеин сыворотки - супрол)
выделяли и очищали биотехнологическим способом путем ионообменной хроматографии
белковых фракций сыворотки, растворимой части эритроцитов и ЭМ на целлюлозах
ДЕ-52 и КМ-52 ("Whatman", Англия), сефадексе ДЕАЕ А-50 ("Pharmacia", Швеция) и
гель-фильтрации на сефадексах G-100 и G-150 (Pharmacia). Цит b558III и цит
b558IV выделяли и очищали без использования детергента, заметно снижающего
стабильность указанных гемопротеинов [10,11]. Количество МП определяли путем
измерения характерной для данного белка плотности максимального оптического
поглощения: для цит b5 - 525, изоформ цит b558 - 530, супрола - 430, ЦП - 610 и
ТФ - 470 нм. Активность cупероксиддисмутазы определяли общеизвестным методом
нитротетразолиевого синего (НТС), путем измерения процента ингибирования
образования формазана в результате восстановления НТС супероксидными
радикалами.
МАА (суммарная фракция Cu,Zn-СОД
и Мn-СОД, каталаза) и МПА (цит С) выделяли из тканей крыс биотехнологическим
способом, с небольшим видоизменением с целью получения также цит С и каталазы
[12].
Оптические спектральные измерения
осуществляли на спектрофотометре "Specord UV-VIS" (Германия) с длиной
оптического пробега 1 см. Статистическую обработку полученных результатов
осуществляли методом вариационной статистики Стьюдента - Фишера, с определением
критерия достоверности Р.
Таблица 1
Относительное изменение (%) уровня МПА и МАА в крови белых
крыс под
воздействием экзогенно введенного ПБП-1, по сравнению с 100%
контрольными
показателями (Р < 0.05, n = 8)
| Металлопротеины |
% |
| Цит b5 |
-25.0+/-3.1 |
| Цит b558 сыворотки |
+102.4 +/- 8.8 |
| Цит b558III ЭМ |
- 80.6 +/- 6.1 |
| Цит b558IV ЭМ |
- 60.9 +/- 4.8 |
| Цит b558 нейтрального характера из ЭМ |
+ 91.7 +/- 6.5 |
| Супрол |
+ 77.6 +/- 5.4 |
| Церулоплазмин |
+ 11.6 +/- 2.0 |
| Трансферрин |
+ 59.5 +/- 4.0 |
| Cu,Zn-CОД |
+ 16.0 +/- 1.8 |
| Каталаза |
- 35.2 +/-
2.4 |
В
результате трехкратного введения крысам по 10 мкг ПБП-1 и дальнейшего
инкубирования крови в аэробных условиях при 4o in vitro уровень МАА и
МПА претерпевает своеобразное изменение (табл.1). Наблюдается снижение уровня
цит b5, компонента для НАДРН-зависимой метгемоглобин редуктазы в цитозоле
эритроцитов [13]. Это свидетельствует о некотором повышении подвижности
животных. Феноменальным можно считать почти двукратное увеличение уровня
синтезированных ex vivo сывороточных цит b558, смягчающих пагубные последствия
перекиси водорода в сыворотке крови и показывающих высокую резистентность этих
цитохромов против перекиси водорода, по сравнению с другими гемопротеинами,
включая и изоформы цит b558 ЭМ [14]. Уровень цит b558 ЭМ значительно снижен под
воздействием ПБП-1, чему способствует подавление процесса рилизинга изоформ цит
b558 пролин-богатым полипептидом [9]. Это вовсе не указывает нa уменьшение
уровня цит b558 в ЭМ, так как значительная часть цит b558 остается еще в
"иммобилизованном" состоянии и отщепляется специальным методом (вторичной
обработкой этих ЭМ). Однако в опытной группе резко повышается уровень цит b558
ЭМ нейтрального характера, что свидетельствует об определенном превращении части
цит b558III кислого характера в цитохром b558 нейтрального характера. Это
своеобразный ответ адаптационных механизмов организма на внешние факторы, каким
и является ПБП-1 (такой эффект наблюдается при различных заболеваниях).
Положительным воздействием ПБП-1 на здоровый организм можно считать увеличение
уровня липопротеина сыворотки высокой плотности - супрола с повышением его
стабильности. Это является важным фактором сохранения вязкости сыворотки и в
целом сохранения гемодинамики.
В приведенном
режиме ПБП-1 вызывает повышение уровня МАА (ЦП, ТФ и Сu,Zn-СОД), но уровень
каталазы продолжает несколько снижаться из-за деградирования при аэробном
инкубировании, а ПБП-1 фактически не способен полностью останавливать процесс
инактивирования каталазы. В крови опытной группы под влиянием ПБП-1 изменение
расчетного суммарного уровня МАА (антиоксидантный статус) и суммарный расчетный
уровень МПА (прооксидантный статус) в целом составляет +52.6 и +95.2%
соответственно, по сравнению с 100%-ными контрольными показателями. Таким
образом, под влиянием экзогенно введенного ПБП-1 прооксидантный статус крови
увеличивается почти в 2 раза по сравнению с антиоксидантным статусом, в основном
из-за увеличения уровня сывороточных цит b558.
Таблица 2
Относительное изменение (%) уровня МАА и МПА в тканях
белых крыс под
влиянием экзогенно введенного ПБП-1 по сравнению с 100%
контрольными
показателями (Р < 0.05, n = 8)
| Ткань |
Цит С |
Cu,Zn-СОД + |
Каталаза |
|
|
+ Мn-СОД |
|
| Мозг |
-47.4 +/-6.1 |
-61.9 +/- 3.7 |
+ 2.1 +/- 0.3 |
| Костный мозг |
-16.7 +/- 2.8 |
+ 375.5 +/- 31.9 |
+ 3.3 +/- 0.4 |
| Тимус |
- 8.9 +/-1.2 |
- 24.3 +/-5.0 |
+ 3.3 +/- 0.4 |
| Селезенка |
+ 29.4 +/- 5.1 |
+ 23.7 +/- 2.7 |
+ 18.2 +/- 3.2 |
| Печень |
- 5.7 +/- 0.6 |
+ 2.2 +/- 0.5 |
- 29.6 +/- 3.2 |
| Сердце |
-101 +/- 1.3 |
-3.1 +/- 0.2 |
-11.4 +/- 2.2 |
| Почки |
-28.6 +/- 3.7 |
+ 4.4 +/- 1.2 |
+ 5.8 +/- 0.6 |
Уровень МАА (фракция Cu,Zn-СОД+Мn-СОД,
каталаза) и МПА (цит С) в различных тканях изменяется по-разному. Уровень цит С
снижается в мозговой ткани, костном мозге, тимусе, печени, сердце и почках от
5.7 до 47.4%. Снижение уровня цит С особенно ощутимо в мозговой ткани (табл.2).
Увеличение уровня цит С наблюдается только в селезенке. Суммарная активность
Cu,Zn-СОД и Мn-СОД снижается в мозговой ткани и тимусе, но практически не
изменяется в печени, сердце и почках. Феноменальным можно считать почти
четырехкратное увеличение активности суммарной фракции Cu,Zn-СОД и Мn-СОД в
костном мозге, основного фактора гемопоеза. В селезенке также наблюдается
увеличение активности этих ключевых антиоксидантных ферментов. Фактически ПБП-1
вызывает повышение антиоксидантной активности органов, ответственных за иммунный
ответ. Видимо, таков механизм действия ПБП-1 при модулировании иммунитета
организма [2]. Однако ПБП-1 вызывает снижение активности каталазы в печени и
некоторое - в сердечной ткани. Ее активность увеличивается только в селезенке. В
других тканях активность каталазы практически не изменяется. Фактически под
влиянием ПБП-1 в здоровом организме наблюдается характерное изменение уровня МАА
и МПА крови и других тканей с резким увеличением уровня сывороточных цит b558,
цит b558 ЭМ нейтрального характера, а также активности Cu,Zn-СОД и Мn-СОД в
костном мозге, что создает определенный дисбаланс между продуцирующими и
утилизирующими АФК металлопротеинами.
Таким
образом, адаптационные механизмы по-разному откликаются на действие внешних
факторов, каким, в частности, является ПБП-1, в здоровом организме и при
заболеваниях с характерным фоном оксидативного стресса, при котором ПБП-1
оказывает антистрессорный эффект [4-6], регулируя эндогенный уровень МАА и МПА в
различных тканях, включая и кровь. При этом чувствительность к ПБП-1 больше в
органах, ответственных за иммунитет организма (селезенка, костный мозг и
тимус).
Институт биохимии им. Г. Х. Бунятяна НАН
РА
Литература
1. Galoyan A. A. Biochemistry
of Novel Cardioactive Hormones and immunomodulators of the Functional System
Neurosecretory Hypothalamus-Endocrine Heart. Moscow. Nauka. 1977. 240 p.
2. Galoyan A. A. Brain
Neurochemistry cytokins: Immune Response and Neuronal Survival. Kluwer Academic
Plenium Publisherrs. N.-Y. 2004. 188p.
3.
Knaryan V., Samannatary S., Galoyan A., Mohanakumar K. - Neuroscience Lett. 2005. V. 375. P. 187-191.
4. Симонян Г. М., Нерсесян А. К., Симонян Р. М., Бабаян М. А.,
Симонян М. А. - Нейрохимия. 2005. Т. 22. С. 125-130.
5. Agadjanov M. I., Vahradyan A. G.,
Simonyan M. A., Galoyan A. A. In: Report of VI Intern. Conf. AD.
Spain. Barcelona. 2002. Р. 152.
6. Оксузян
Г. Р., Симонян М. А., Галоян А. А. - ДНАН РА. 2003. Т. 103. С.
160-166.
7. Варданян А. Р., Симонян Р. М.,
Бабаян М. А., Геворкян Д. Н., Симонян М. А. - Нейрохимия. 2004. Т.
21. С. 289-292.
8. Sulkhanyan R. M.,
Chavushyan E. A., Sarkissian J. S., Galoyan A. A. - 34 rd ASN
Annual Meeting (USA). Neurochemistry. 2003. V. 85. P. 16.
9. Симонян Р. М., Симонян Г. М., Бабаян М. А., Симонян М. А. -
Мед. наука Армении. Т. 43. С. 13-18.
10. Симонян М. А., Симонян Г. М. Способ получения
металлопротеинов крови. Лицензия изобрет. No 341 Армпатента. Ереван. 1997.
11. Симонян М. А., Симонян Г. М., Симонян
Р. М. Способ получения цитохромов b из мембран эритроцитов.
Лицензия изобрет No 908 Армпатента. Ереван. 2001.
12. Симонян М. М. Способ получения СОД из животного сырья.
Открытия, изобрет. (СССР). 1988. Т. 28. С. 107.
13. Passon P. G., Hultquist D. E. - Biochim. Biophys Acta.
1972. V. 273. P. 62-73.
14. Симонян Г. М.,
Симонян Р. М., Симонян М. А. В кн: Актуальные вопросы военной
медицины. Ер. гос. мед. ун-т. им. М. Гераци. Ереван. 1999. C. 48-51.
![]() -продуцирующий липопротеин сыворотки - супрол)
выделяли и очищали биотехнологическим способом путем ионообменной хроматографии
белковых фракций сыворотки, растворимой части эритроцитов и ЭМ на целлюлозах
ДЕ-52 и КМ-52 ("Whatman", Англия), сефадексе ДЕАЕ А-50 ("Pharmacia", Швеция) и
гель-фильтрации на сефадексах G-100 и G-150 (Pharmacia). Цит b558III и цит
b558IV выделяли и очищали без использования детергента, заметно снижающего
стабильность указанных гемопротеинов [10,11]. Количество МП определяли путем
измерения характерной для данного белка плотности максимального оптического
поглощения: для цит b5 - 525, изоформ цит b558 - 530, супрола - 430, ЦП - 610 и
ТФ - 470 нм. Активность cупероксиддисмутазы определяли общеизвестным методом
нитротетразолиевого синего (НТС), путем измерения процента ингибирования
образования формазана в результате восстановления НТС супероксидными
радикалами.
-продуцирующий липопротеин сыворотки - супрол)
выделяли и очищали биотехнологическим способом путем ионообменной хроматографии
белковых фракций сыворотки, растворимой части эритроцитов и ЭМ на целлюлозах
ДЕ-52 и КМ-52 ("Whatman", Англия), сефадексе ДЕАЕ А-50 ("Pharmacia", Швеция) и
гель-фильтрации на сефадексах G-100 и G-150 (Pharmacia). Цит b558III и цит
b558IV выделяли и очищали без использования детергента, заметно снижающего
стабильность указанных гемопротеинов [10,11]. Количество МП определяли путем
измерения характерной для данного белка плотности максимального оптического
поглощения: для цит b5 - 525, изоформ цит b558 - 530, супрола - 430, ЦП - 610 и
ТФ - 470 нм. Активность cупероксиддисмутазы определяли общеизвестным методом
нитротетразолиевого синего (НТС), путем измерения процента ингибирования
образования формазана в результате восстановления НТС супероксидными
радикалами.