БИОХИМИЯ
УДК 577.15
Л. П. Тер-Татевосян, Л. В. Саркисян, И. Г. Асланян,
академик А. А. Галоян
Влияние PRP-1 на активность некоторых фосфатаз в костном
мозге
белых крыс в норме и при раздражении нейросекреторных ядер
гипоталамуса
(NPV и NSO)
(Представлено 3/IV 2006)
Ключевые слова: щелочная фосфатаза, кислая фосфатаза, неорганическая пирофосфатаза,
казеинфосфaтаза, PRP-1
Одна из наиболее актуальных проблем при
изучении углеводно-фосфорного обмена - выявление возможных регуляторов фосфатаз,
среди которых гормоны имеют первостепенное значение. Влияние гормонов на обмен
веществ и энергии осуществляется в основном через определенные ферменты, причем
гормоны влияют либо непосредственно на их синтез, либо на синтез других веществ,
участвующих в конкретном ферментативном процессе. Гипоталамус, являясь частью
как нервной, так и эндокринной систем, выделяет пептидно-белковые факторы,
контролирующие выделенные гипофизом гормоны, часть которых непосредственно
воздействует на биохимические процессы в тканях. В этом отношении особенно
интересны выделенные академиком А. А. Галояном из гипоталамуса быка
иммуностимулирующие нейропептиды, являющиеся регуляторами для ряда ферментов
углеводно-фосфорного обмена [1- 3].
В
настоящей работе исследованы роль и механизм действия одного из биоактивных
пептидов гипоталамуса PRP-1 (пролин-богатый пептид - галармин-1) на активность
ряда фосфатаз в костном мозге крыс, где происходит зарождение новых лимфоцитов,
несущих ответственность за иммунную систему организма
[4].
Опыты ставились in vitro на гомогенатах
костного мозга белых крыс. Первая серия опытов ставилась на здоровых крысах
массой 120-150 г с использованием галармина-1 в концентрациях от 0.5 до 10 g с интервалами. Во второй серии крысы массой 200-250 г были
подвергнуты стимуляции гипоталамических ядер под нембуталовым наркозом.
Раздражающий электрод вводили в nSO и n-PaLM прямоугольными электрическими
импульсами длительностью 1 с c частотой 100 Гц, с общей протяженностью
стимуляции 15 мин (3 раза с интервалом 5 мин), после чего по истечении 15 мин
крысы забивались для изъятия костного мозга [5].
Активность щелочной (КФ 3.1.3.1) и кислой (КФ 3.1.3.2) фосфатаз
определяли методом Шлыгина и Михлина [6]. В качестве субстрата использовали
паранитрофенилфосфат ("Reanal") в концентрации 2 · 10-3М в мединаловом буфере с рН 9.6 для щелочной
фосфатазы и рН 4.6 - для кислой. Об активности этих ферментов судили по
нарастанию паранитрофенола в течение 30 мин при 30oС. Активность
неорганической пирофосфатазы (КФ 3.6.1.1) определяли методом Геппеля [7],
субстратом данного энзима был неорганический пирофосфат Na в мединаловом буфере
с рН 7.2. Активность фосфопротеинфосфатазы (КФ 3.1.3.16) с казеином в качестве
субстрата (рН 6.2) в экстрактах определяли по Фанштейну, Фольку [8]. По
количеству отщепившегося от субстрата неорганического фосфора судили о
ферментативной активности казеинфосфатазы и неорганической пирофосфатазы,
которую выражали в микромолях фосфора на грамм ткани в минуту (Е) [9]. Для всех
четырех ферментов приведены средние данные 5-6 опытов, статистически
достоверные.
|
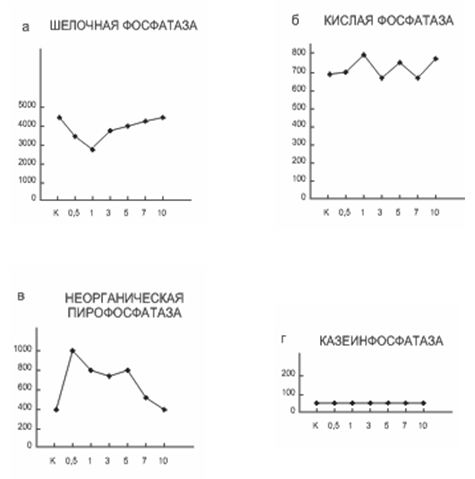
|
Рис. 1. Активность фосфатаз в костном мозге белых крыс под
действием галармина. По оси абсцисс -
галармин в g; по
оси ординат - активность фермента в Е. а, б - E = мк моль фенола/ г тк. мин, в, г
-
Е = мк моль Р/ г тк. мин
Ранее нами было показано, что некоторые пептиды гипоталамуса приводят к
сдвигам в активности щелочной фосфатазы [2]. Аналогичная картина наблюдается и в
случаях с PRP-1 (рис.1,а), где все используемые дозы пептида оказывают
подавляющее действие на ферментативную активность: PRP-1 в дозе 0.5 и 1 g снижает активность щелочной фосфатазы костного мозга на 40%
по сравнению с контролем, в то же время фиксируется частичная потеря
чувствительности этого энзима (20%) к высоким концентрациям пептида (3-10 g). Снижение активности фермента предположительно связано с
конформационными изменениями его активного центра, ибо для щелочной фосфатазы
необходимы соответствующие количества ионов двухвалентных металлов в качестве
кофакторов для компенсации зарядов на фосфатной группировке и облегчения
нуклеофильной атаки гидроксильной группы серина на фосфор [10]. Кислая фосфатаза
костного мозга крысы (рис.1,б) характеризуется несколько иными свойствами, чем
щелочная. Kривая eе активности носит более плавный характер и нет линейной
зависимости от доз пептида. Различия в каталитических центрах и структурах этих
двух моноэстераз (кислой и щелочной фосфатаз), по всей вероятности, и является
причиной расхождения в характере ответных реакций на действие данного
пептида.
Существует ряд доказательств важного
значения пирофосфата как в регуляторной деятельности некоторых ферментативных
процессов, так и в обеспечении постоянного уровня макроэргических соединений
[11]. Обмен неорганического пирофосфата осуществляется пирофосфатазой -
специфическим ферментом, расщепляющим пирофосфорную кислоту на молекулы
ортофосфорной кислоты. Результаты определения зависимости пирофосфатазы костного
мозга крыс от PRP-1 приведены на рис.1,в. Как видно из кривой, ферментативная
активность наиболее высока при минимальной дозе нейропептида (0.5g), с повышением же количества галармина наблюдается обратная
корреляция, и при наличии в инкубационной среде 10 g
PRP-1 активность пирофосфатазы приравнивается к норме. Как показывает кривая
1,г, эффект действия гипоталамического пептида зависит не только от его
концентрации, но и от природы фермента, на который он действует. Для
казеинфосфатазы костного мозга крысы абсолютная величина ферментативной
активности под действием различных доз галармина практически не отличается от
контрольных величин. Для всех групп животных этот показатель очень мал и равен
40 мкМ Р/ тк мин. Результаты данной серии опытов позволяют судить о
потенциальных возможностях регуляции обмена фосфопротеинов на участке,
находящемся под контролем фосфатаз, где нейрогормонам отведена не последняя
роль.
Гормоны гипоталамуса выделяются
нервными клетками, собранными в группы (ядра гипоталамуса) и связанными с
гипофизом сетью кровеносных сосудов и нервов. При поражении ядер гипоталамуса
повреждаются макромолекулы живой клетки со сдвигами в обмене веществ, с
нарушениями на уровне отдельных органов и тканей. Существенные морфологические и
биохимические нарушения возникают в нервной ткани, развивается соответствующая
патология, при которой фосфатазы подвергаются изменениям [3, 12]. Была проведена
серия экспериментов по изучению эффекта разрушения гипоталамических ядер на
активность ферментов в костном мозге крыс. Как видно из рис.2, сдвиги в
активности исследуемых фосфатаз при данной патологии носят не только
количественный, но и качественный характер. Максимальной ферментативной
активностью отличается щелочная фосфатаза - имея в контроле 4500 Е, ее
активность возрастает до 6000 Е у опытных крыс.
|

|
Рис. 2. Активность фермента в костном мозге белых крыс в
норме и после раздражения ядер
гипоталамуса (NPV и NSO): I -
□ - котроль, I I -
■ - опыт;
по оси абсцисс: 1- щелочная фосфатаза, 2-
кислая фосфатаза, 3- неорганическая пирофосфатаза,
4- казеинфосфатаза; по оси ординат -
активнисть фермента в Е, 1,2 - E = мк моль
фенола/ г тк. мин, 3,4 - Е = мк моль Р/ г тк. мин
Неорганическая пирофосфатаза, проявляя высокую
энзиматическую активность у здоровых крыс (1600 Е), к данной патологии не
чувствительна. Казеинфосфатаза, исследованная в тех же условиях, неактивна как у
интактных животных, так и у крыс, подвергшихся раздражению гипоталамических
ядер. Особый интерес представляет кислая фосфомоноэстераза костного мозга крысы.
Как видно из графика (рис.2), каталитическая активность данного фермента в норме
составляет 660 Е, после стимуляции ядер NPV и NSO резко возрастает, доходя до
1980 Е, что составляет трехкратное повышение ферментативной активности. Подобный
скачок кислой фосфатазы можно предположительно объяснить выбросом PRP-1, которые
прямо и косвенно стимулируют активацию энзима. Это предположение подтвердилось
иммуногистохимическими исследованиями, где in vivo морфологически было доказано
увеличение структур, резко активирующих кислую фосфатазу костного мозга крысы
[13]. Рассмотрев полученные данные, приходим к заключению, что на фоне
функциональной реактивности нервной ткани в ответ на поражение организма уровень
активности фосфатаз подвергается определенным сдвигам, выражающимся в одних
случаях в нарастании процесса катаболизма, в других - в преобладании скорее
компенсаторных механизмов.
Таким образом,
гипоталамические пептиды прямо или косвенно принимают активное участие в
регуляции метаболизма фосфопротеинов через фосфатазы.
Авторы выражают благодарность за помощь
сотрудникам лаборатории компенсации функций ЦНС Института физиологии им. Л. А.
Орбели HAH PA.
Институт биохимии им. Г. Х. Бунятяна НАН
РА
Литература
1. Тер-Татевосян Л. П., Саркисян Л. В.,
Асланян И. Г., Галоян А. А. - ДНАН PА. 2004. T. 104. N 3. C.
228-233.
2. Тер-Татевосян Л. П., Саркисян
Л. В., Асланян И. Г., Галоян А. А. - ДНАН PА. 2004. T. 104. N 4.
C. 343-348.
3. Galoyan A. Armen. In: Brain Neurosekretory cytokines, Immune Response and Neuronal
Survival. Kluwer Academic Plenum Publishers. 2004. P. 1-188.
4. Fontenay M., Bryckaert M., Tobelem G. -
J. CM Physiol. 1992. V. 152. N 3. P. 507.
5. Paxinos G., Watson C. The Rat Brain in
stereotaxic coordinates. ACADEMIC PRESS inc, 1986.
6. Шлыгин Г. К., Михлин С. Я. - Вопр. мед. химии. 1955. N
1. C. 468.
7. Heppel L. A. - Metods in Enzymology. 421. New York. 1955. V.2. P. 570-574.
8. Feinstein R. N., Folk M. E. - J. Biol. chem. 1949. V. 177. P. 339-344.
9. Taussky H. H., Shorr E. J. - Biol. Chem.. 1953. V. 202.
P. 675-685.
10. Hauson A. W., Applebury M.
L., Coleman I. E., Wyckoff. - J. Biol. Chem. 1970. V. 245. P.
4975-4976.
11. Flodgaard H., Frenor P. -
Abstracts 9th internat. Cougr. Biochem. Stockholm. 1973. P. 218.
12. Prelot M., Do T. X., Planchenault P.,
Glrault. A. - Arch. Int. phyziol/ et. Biochem. 1990. V. 98. N 1.
C. 59-66.
13. Melikyan N. - Electronic Journal of Natural sciences (National Academy of Sciences of
RA) 2005. T. 2. N 5. P. 12-147.

