НЕОРГАНИЧЕСКАЯ ХИМИЯ
УДК 666. 112.9
М. З. Петросян, Н. Б. Князян, академик К. А. Костанян
Стеклование, структурные особенности и электропроводность
стекол
системы V2O5 - B2O3 -
BaF2
(Представлено 28/VIII 2006)
Ключевые слова: стеклообразование, электропроводность, бораты, фториды,
ванадаты
Оксиды B2O3 и
V2O5, значительно отличающиеся по строению, предопределяют
сложность строения стекол на их основе, нелинейный характер изменения ряда
свойств, особенно электрических, ввиду присутствия в составе стекол элемента
переменной валентности. Наличие широких областей стеклообразования в
ванадиевоборатных системах с щелочноземельными катионами и возможность получения
стекол с высоким содержанием V2O5 и низким
B2O3 позволяют полагать, что роль и положение ванадия в
структуре таких стекол могут быть различны в зависимости от концентрации
модификаторов.
В кристаллическом
V2O5 группы VO3+ связаны посредством двух- и
трехкоординированных ионов кислорода таким образом, что получается
координационное число 5 по ванадию [1]. Группы VO5 связаны друг с
другом частично вершинами, частично ребрами и образуют слои, причем в каждой
группе один атом кислорода немостиковый. По способности образовать стекло
B2O3 является типичным стеклообразователем. Оксид бора
существует в двух кристаллических модификациях: гексагональной, структура
которой построена из неправильных тетраэдров BO4, и орторомбическая,
где часть атомов бора находится в тройной координации. Систематические
исследования стеклообразующих ванадатных систем с типичным стеклообразователем
B2O3, являющимся стабилизатором в многокомпонентных
стеклах, свидетельствуют, что при изменении концентрации
B2O3 и модифицирующего катиона могут реализоваться
многообразные формы ближнего порядка (VIV, VV,
BIII, BIV) [2]. Вследствие окислительно-восстановительных
процессов, происходящих в стеклообразующем расплаве при высоких температурах,
возможно также частичное выделение кислорода [3].
Целью данной работы являлось изучение стеклообразования и влияния
фторида бария на фазовый состав продуктов кристаллизации и на электрические
характеристики стекол системы V2O5 - B2O3 - BaF2. Синтез стекол с содержанием до 50 мол.%
BaF2 производился в корундовых тиглях в электрической печи в
атмосфере воздуха при температурах 800-1000oС с выдержкой 60 мин.
Стекла синтезировались из химически чистых реактивов V2O5,
H3BO3 и BaF2. Дериватограммы порошков стекол
сняты на дериватографе Q-1500, скорость нагрева 10oмин-1. Рентгенограммы порошков закристаллизованных стекол
получены на дифрактометре ДРОН 2 с медным излучением (l
= 1.542 Ao) c никелевым фильтром, скорость съемки
2o/мин.
Электрические свойства в
температурном интервале от комнатной до температуры стеклования измерены при
постоянном и переменном напряжении, электроды
графитовые.
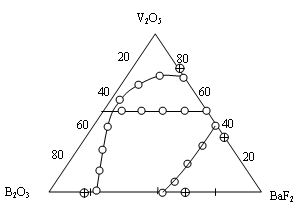
На рис. 1 приведены область
стеклообразования в системе V2O5 - B2O3 - BaF2 и составы исследованных стекол.
|
|
Рис.1. Область стеклообразования:
Е - стеклосодержащие кристаллические включения;
⃝ -
стекло.
Трехкомпонентные
системы, содержащие два стеклообразующих оксида (B2O3 и
V2O5), сохраняют общую тенденцию в образовании двух
областей стеклообразования, которые обусловлены стремлением
(BIII,BIV) и (VIV,VV) к образованию
в стекле своего характерного кислородного (в нашей системе оксифторидное)
окружения. Основное отличие фторсодержащей системы от оксидной - это расширение
областей стеклообразования в бинарных системах B2O3 - BaF2 и V2O5 - BaF2, что, по всей вероятности, обусловлено
координационным сдвигом BO3 ® BO4,
VO4 ® VO5 в сторону образования
групп BO4 и VO5 и уменьшением склонности расплавов к
расслоению.
В бинарных системах
B2O3 - BaF2 и
V2O5 - BaF2 стекла
образуются при содержании от 32 до 54 мол.% и от 27 до 52 мол.% BaF2
соответственно. Отсутствие гомогенных стекол в бинарной системе
B2O3 - V2O5 и тройной, примыкающей к
двойной системе V2O5 - B2O3
объясняется ограниченной взаимной растворимостью компонентов в субсолидусной
области и широкой областью метастабильной ликвации в бинарной системе
[4].
На основании кристаллохимического
подхода к трактовке структуры борванадатных стекол, включающего изотермическую
обработку стекол при температурах экзотермических эффектов на ДТА стекол с
последующей идентификацией образовавшихся кристаллических фаз, определены
доминирующие структурные мотивы на основе бора и ванадия при увеличении
концентрации BaF2 по разрезу V2O5 = 50
мол.%.
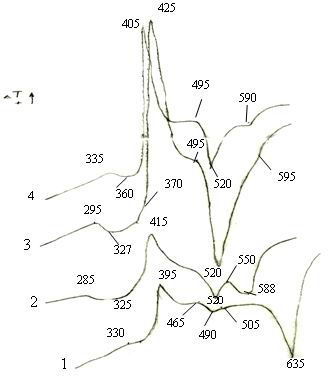
На кривых ДТА порошков стекол (рис.2),
содержащих до 30 мол.% BaF2, проявляются широкие пики с малой
высотой, указывающие на высокие величины активационного барьера кристаллизации.
|
|
Рис. 2 Кривые ДТА стекол по разрезу
V2O5 = 50 мол.%,
содержащиx:
1- BaF2 = 20 мол.%, 2- BaF2 = 30 мол.%, 3- BaF2 = 40 мол.%, 4- BaF2 = 50 мол.%.
Увеличение в стекле количества фторида, участвующего
в образовании оксифторидных группировок, по-видимому, приводит к уменьшению процесса
трехмерного структурирования каркаса стекла за счет увеличения концевых связей
фтора и смещения равновесия координационных переходов BO4 ® BO3, VO4 ®
VO5. Деполимеризация пространственной структуры приводит к
значительному уменьшению температуры стеклования стекол (tg ) примерно
на 50oС и температуры ликвидуса системы (tL ) на 45oС.
В продуктах кристаллизации этих стекол кроме бората и ванадата бария
идентифицированы также фторсодержащие бораты и ванадаты. Присутствие в продуктах
кристаллизации мета-Ba(VO3)2 ,
пиро-Ba2V2O7 и орто-
Ba3(VO4)2 ванадатов бария свидетельствует о
том, что последовательность образования основной единицей структуры
стеклообразного каркаса при уменьшении количества стеклообразующего оксида
B2O3 зависит от концентрации вводимого катиона
модификатора (Ba2+). При высoком соотношении
B2O3/V2O5, по-видимому,
пространственная структура стекла строится преимущественно из цепочек
BO3 и VO3 групп, связанных общими вершинами, при этом
катионы модификатора располагаются в пустотах решетки. Одновременно происходят
координационные переходы BO3 ® BO4
[2]. Переход атомов бора в четверную координацию может быть двояким:
донорно-акцепторная связь BIV-O может
являться боковой и мостиковой. Только во втором случае эта связь приводит к
дополнительному пространственному увязыванию ванадатных и боратных групп
V(O,F)4 и B(O,F)4. Образование оксифторидных боратных и
ванадатных групп подтверждается наличием в продуктах кристаллизации стекол
соединений BaBO3F и Ba5F(VO4)3.
Переход в многофторидную область составов выражается в крутом подъеме ветвей
экзоэффектов (увеличение кристаллизационной способности стекол) и снижением
температуры ликвидуса системы. Начиная с определенной концентрации
BaF2 часть фтора, вводимого с модификатором, превращается в
немостиковый по схеме [B(OF)4/2]2-Ba2+
⇌
[BO3/2F-]2Ba2+ и приведенное равновесие
смещается вправо, т.е. образование боратных тетраэдров уменьшается
[5].
Деполимеризация структуры стекла, при
которой значительная часть фтора (частично и кислорода) может стать концевой,
локализоваться близ катиона модификатора (Ba2+) и в координационном
окружении ванадия, способствует получению многофторидных ванадатных стекол. По
сравнению с чисто оксидной системой BaO - V2O5 температура ликвидуса снижается
на 115-120oС [6], что способствует получению стекол, содержащих до 55
мол.% BaF2. То обстоятельство, что все ванадаты бария плавятся
инконгруентно с образованием расплава и BaO, создает возможность активного
участия иона модификатора в координационных переходах бора и ванадия с
компенсацией электрического заряда. При постепенном уменьшении
B2O3 в составе стекол большое значение для получения
устойчивых стекол приобретают степень диссоциации V2O5 и
состав анионов в стеклообразующем расплаве. По-видимому, при соотношении
B2O3/V2O5 »
1 и низком содержании BaF2 в структуре стекла образуется в целом
''слоистая'' структура, включающая полиэдры бороксольных колец
B3O6 и тетраэдрические группы BO4 и
VO4. При малом содержании BO4 групп каждое пятиугольное
пространство, образованное атомами кислорода, входящими в состав полиэдров
VO4, и плоские B3O6 кольца соединяются
щелочноземельными металлами, осуществляющими одновременно связь между слоями
[7]. По мере уменьшения соотношения
B2O3/V2O5 при увеличении
BaF2 в центральной области составов системы в продуктах
кристаллизации превалируют боратные соединения бария (bBaB2O4, BaBO3F) и
Ba(VO3)2, где бор находится и в четверной, и в тройной
координации, а ванадий преимущественно в четверной координации. Т.е. можно
предположить, что взаимодействие между боратной и ванадатной составляющими
стекла реализуется в результате образования чередующихся связей B - O - V, приводящих к трехмерному
увязыванию каркаса. Совместимость структурообразующих групп увеличивает
температурную область трансформации стекол (tg - tf) от 15 до 40oС. При меньшем
содержании в стекле B2O3(< 10 мол%) основными
кристаллическими фазами являются ванадаты бария.
На кривых ДТА этих стекол имеются экзотермические эффекты при 405-425 и
495-500oС, обусловленные образованием вначале мета-, а затем
пированадата бария. При 590-595oС наблюдаются эндотермические эффекты
перитектического плавления метаванадата.
Ответственными при образовании каркаса многованадатных стекол могут
являться VO4 тетраэдры, тригонально бипирамидальные и тетрагонально
пирамидальные группы VO5. В работе [2] не исключается возможность
образования групп VO6 в стеклах, содержащих
V2O5 50 мол.% и более.
Установлено,что электрическая проводимость ванадатных стекол
определяется присутствием ионов V4+ и V5+, и
полупроводниковый характер политерм проводимости, низкая подвижность носителей
заряда объясняются перескоковым механизмом проводимости. В соответствии с этим
проводимость ванадатных стекол (ванадатов) обусловлена перескоками поляронов
между ионами V4+ и V5+. Вклад ионной составляющей с ростом
температуры может возрастать или уменьшаться в зависимости от вида
модифицирующего катиона [3]. Политермы проводимости исследованных стекол
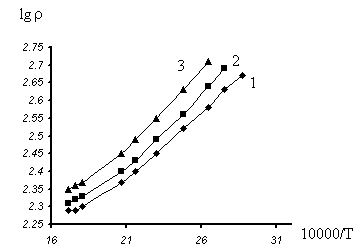
приведены на рис. 3.
Удельная проводимость
(s) на постоянном токе, в целом, имеет экспоненциальную
зависимость от 1/Т с энергией активации Es = 0.079 эв. Более резкий спад на политерме проводимости
в области температуры 25-100oС связан, по-видимому, с изменением
электронной составляющей проводимости. Считают, что в ванадатных стеклах и
кристаллах электороперенос связан с переносом электронов по локализованным
состояниям, а рост электронной составляющей и уменьшение энергии активации
проводимости с увеличением температуры - с увеличением вероятности перескоков за
счет
Рис. 3. Температурная зависимость удельного сопротивления
стекол от температуры:
1- V2O5:
B2O3 = 5 : 3, 2-
V2O5:B2O3 = 5 : 2,
3-
V2O5:B2O3 = 5 : 1.
перекрывания молекулярных орбиталей [8]. На политермах можно
отделить два линейных участка: область высоких температур, где проводимость
осуществляется прeимущественно электронами, локализованными на ионах ванадия
(Es = 0.047 эв), и область низких температур,
где преобладает ионная составляющая по фтору (Es = 0.079эв). Температурная зависимость диэлектрической
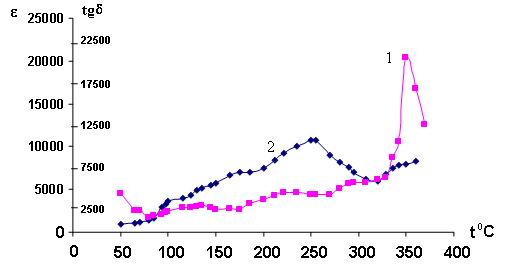
проницаемости и тангенса угла диэлектрических потерь приведены на рис. 4.
Рис. 4. Температурная зависимость диэлектрической
проницаемости (1) e и тангенса угла
диэлектрических
потерь (2).
На кривых зависимостей tgs = f(t)
и e = f(t) фиксируются четко выраженные максимумы в области
температур 240-350oС. Такое резкое изменение кривых, по мнению многих
исследователей [9], свидетельствует об изменении характера релаксационных
процессов и типа проводимости при нагревании образца. О механизме проводимости
можно также судить по величине энергии активации процесса и электропроводности
стекла.
Низкие значения Es(< 0.079эв) и удельного сопротивления
предопределяют электронный характер проводимости стекол [10].
Государственный инженерный университет
Армении
Литература
1. Абдулаев А. А., Кисловский Л. П. - Кристаллография. 1970. T. 15. C. 988.
2. Hubert T., Mosel G., Witke K. - Физика и химия стекла.
T. 27. N2. 2001. C. 172.
3. Фотиев А. А. ,
Слободин Б. В. Ванадаты, Состав, синтез, структура, свойства. М.
Наука. 1988. 272 c.
4. Мальцев В. Т. ,
Чобанян П. М. - Журн. неорганической химии. 1974. T.19. N 6. C.
1617-1620.
5. Костанян К. А. , Князян Н. Б.
, Гаспарян Л. А. - Хим. журнал Армении. 2004. T. 57. N 1-2. C.
14.
6. Фотиев А. А. , Макаров В. Л. - Журн. неорганической химии. 1969. T. 14. N 1. C.
277-281.
7. Красненко Т. И., Фотиев А. А. -
Изв. АН СССР. Неорганические материалы. 1983. T. 19. N5. C.
803.
8. Attos O., Massot M., Balkanski M.,
Haro-Poniatowski E., Asomoza M. - J. Non-Cristalline Solids. 1997.
V. 210. P. 163-170.
9. Ingram M. D. - Phys. Chem. Glasses. 1987. V. 28. P. 215.
10. Гречаник Л. А., Файнберг Е. А., Зерцалова И. Н. В сб.:
Электрические свойства и строение стекла. М. - Л. Химия. 1964. C. 30.