УДК 577.612.327. 324
Cупероксиддисмутаза-миметическая активность соединения
ВАС-167
и его воздействие на металлопротеины крови in vitro
(Представлено 30/XI 2005)
Ключевые слова: соединение ВАС-167, металлопротеины, супероксиддисмутаза
Соединение ВАС-167, являясь производным
4-бутанолида, оказывает противоопухолевый эффект в эксперименте [1], корригирует
глицерокиназный и гликолитический пути фосфатидогенеза в легочной ткани [2], а
также липидный и энергетический обмен кардиомиоцитов при ионизирующей радиации
[3,4]. Однако молекулярно-биохимические механизмы воздействия соединения ВАС-167
на металлопротеины (МП) крови пока не установлены.
Цель работы залючается в выявлении возможной антиоксидантной активности
соединения ВАС-167 и его воздействия на состояние МП крови - регуляторов
метаболизма активных форм кислорода (АФК) in vitro.
Порошок соединения ВАС-167 (50 мг) был растворен в 10 мл этанола при
40-45o в течение 15-20 мин (этот матричный раствор использовали в
дальнейшем). МП донорской крови антиоксидантной активности (МАА) (Cu,Zn-СОД,
церулоплазмин (ЦП), трансферрин (ТФ) и каталаза) и металлопротеины
прооксидантной активности (МПА) (цитохром (цит) b558III, выделенный из
эритроцитарных мембран (ЭМ), и супероксид-продуцирующий липопротеин сыворотки -
супрол)) получали и очищали биотехнологическим способом с использованием
ионообменной хроматографии (на целлюлозах ДЕ-52, КМ-52, ДЕАЕ А-50) и
гель-фильтрации (на сефадексах G-75 и G-100) до электрофоретически гомогенного
состояния [5] без использования детергента для солюбилизации белков из ЭМ
[6].
Супероксиддисмутазную (СОД) активность
проб определяли методом: 1) нитротетразолиевого синего (НТС), основанным на
определении процента понижения плотности максимального оптического поглощения
формазана (при 560 нм), образовавшегося в результате восстановления НТС
супероксидными радикалами (О2-).
За единицу СОД активности принимали количество фермента (проба), подавляющее
образование формазана на 50% [7]; 2) обоснования кумасии бриллианта синего (КБС)
супероксидными радикалами (при 580 нм), продуцируемыми расщеплением перекиси
водорода при рН 7.4 и выше [8]; 3) количественного определения стационарной
концентрации О2-, продуцируемых
при расщеплении перекиси водорода (при рН 8) путем расчета интегральной
интенсивности характерного для О2- ЭПР спектра с g = 2.02 (фактор Ланде) и сравнения с
аналогичными показателями другого парамагнетика с известной концентрацией
(5х10-4 М CuCl2)
[9].
Определенные количества МАА и МПА (по 3
мл) в отдельности были смешаны с 0.025 мг/мл ВАС-167, растворенным в этаноле, и
инкубированы в течение трех суток при 4o в аэробных условиях. К
контрольным пробам был добавлен этанол в тех же количествах. Каталазную
активность проб определяли перманганатометрическим титрованием путем расчета
концентрации расщепленной перекиси водорода за 1 мин при 20o
определенным количеством каталазы. НАДРН-зависимую О2--продуцирующую активность цит b58III [10] и супрола
[11] определяли НТС-методом в отсутствиe и присутствии ВАС-167, рассчитав
процент увеличения плотности максимального оптического поглощения формазана под
воздействием определенных количеств белков. За единицу О2- -продуцирующей активности принимали количество белка,
вызывающее 50%-нoe увеличение плотности оптического поглощения формазана (при
560 нм). Метгемоглобин (метНb)-восстанавливающую активность цит b558III в
отсутствиe и присутствии ВАС-167 определяли путем расчета снижения плотности
альфа-поглощения (заштрихованная часть спектра) метНb (А565 = 0.9) под
воздействием цит b558III (плотность оптического поглощения цит b558III при 530
нм в 3 мл реакционной смеси составляла 0.02) после суточного инкубирования
реакционной смеси при 4, затем при 30o в течение 5 ч
[12].
Оптические спектры поглощения проб
регистрировали на спектрофотометре "Specord UV/VIS" (Германия) с длиной
оптического пробега 1 см при 20o. ЭПР-спектры проб регистрировали на
спектрометре "Varian E-9" (США) при температуре жидкого азота-196oС.
Условия регистрирования ЭПР спектров таковы: чувствительность записи спектров
103, модуляция амплитуды 10 Гаусс, микроволновая частота 9.08 гГц,
микроволновая мощность 10 мв, постоянная времени 0.3 с, напряженность
постоянного магнитного поля 3000 Гаусс.
Статистическую обработку полученных результатов осуществляли
общеизвестным методом вариационной статистики Стьюдента-Фишера с определением
критерия достоверности. Расчеты показали, что СОД-миметическая активность
соединения ВАС-167 составляет около 3% (сравнивается с активностью Cu,Zn-СОД,
составляющей 3000 ед/мг). Это дoвольно высокий показатель для СОД-миметических
комплексов [13]. СОД-миметическая ативность ВАС-167 не подавляется при хранении
препарата в этаноле при 4o в течение месяца и более. Преимущество
ВАС-167 по сравнению с Cu,Zn-СОД состоит в том, что перекись водорода (уровень
этого активного соединения кислорода почти всегда повышается при различных
заболеваниях) не подавляет его СОД-миметическую активность, как это имеет место
при Cu,Zn-СОД, который в присутствии этой перекиси после дисмутирования
супероксидов уже более интенсивно продуцирует их из-за восстановления меди в
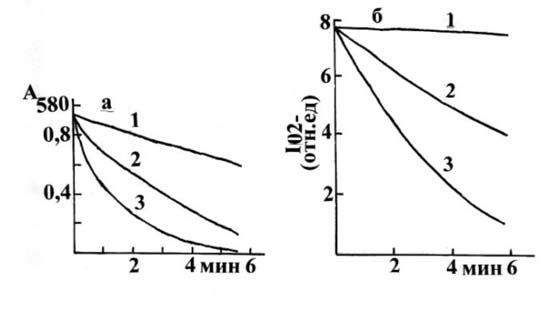
активном центре фермента [14]. Процесс обесцвечивания КБС супероксидными
радикалами, продуцируемыми при расщеплении перекиси водорода (10-3М) при рН 8, существенно подавляется под воздействием
0.025 мг/мл ВАС-167 или каталитических количеств Cu,Zn-СОД (5х10-8М) (рис. 1). ВАС-167, а также Cu,Zn-СОД снижают
интегральную интенсивность ЭПР сигнала О2- (рис. 2) в приведенной системе продуцирования
супероксидов. Можно констатировать, что соединение ВАС-167 обладает стабильной
СОД-миметической активностью и не денатурируется перекисью водорода, уровень
которой существенно повышается при оксидативном стрессе различного характера
[13].
|
|
Немаловажное значение имеет и то, что ВАС-167 практически не изменяет свойств (оптико-спектральные характеристики) ряда ключевых МАА: ЦП, ТФ (рис.3), а также Cu,Zn-СОД при инкубировании ВАС-167 (0.025 мг/мл) с этими МП в течение трех суток при 4o. Не меняются и свойства (оптико-спектральные показатели) новых МПА - цит b558III и супрола (рис.3), не подавляется и их супероксид-продуцирующая активность in vitro.
|
|
|
|
Однако
ВАС-167 несколько подавляет активность каталазы (12.2 +/-1.1, Р < 0.05, п = 8),
вызывая небольшую деградацию этого фермента (рис. 2), и метНb-восстанавливающую
активность цит b558III (15.4 +/-1.2, Р < 0.05, п = 8) (рис.4), что
нежелательно, так как при анемии (при злокачественных новообразованиях [15])
происходит повышение уровня метНb, который не способен перенести кислород к
клеткам. Соединение ВАС-167 не снижает супероксид-продуцирующую активность
супрола и НАДРН-зависимую супероксид-продуцирующую активность цит b558III. В
отличие от Cu,Zn-CОД ВАС-167 не инактивируется перекисью водорода и улавливает
супероксидные радикалы, продуцируемые при расщеплении этой перекиси. Cоединение
ВАС-167 в подавляющем большинстве не денатурирует МАА и МПА и обладает
антиоксидантной активностью. Однако поскольу исследования осуществлены в
условиях in vitro, пока трудно определить, как влияет ВАС-167 in vivo на такое
свойство цит b558III. Институт гематологии МЗ РА
Таким образом,
препарат ВАС-167 как антиоксидант оказывает положительнoe регулирующee
воздействие при оксидативном стрессе различного характера, при котором
наблюдается повышение прооксидантного статуса организма.
Институт биохимии им. Г. Х. Бунятяна НАН
РА
Ереванский государственный yниверситет
1. Арутюнян В. С., Кочикян Т. В., Аветисян
А. А., Кинзирский А. С. В кн.: Актуальные проблемы
экспериментальной и клинической медицины. Ереван. 1998. C. 409-412.
2. Казарян П. А., Саакян Л. С., Егиазарян
А. Р., Григорян А. Г., Бегларян М. К. - Ученые записки ЕГУ. 2002.
Т. 1. C. 86.
3. Егиазарян А. Р. - Материалы 3-го конгресса онкологов закавказских государств. МЗ РА и
Онкол. центр МЗ РА. Ереван. 2004. C. 102.
4. Sahakyan R. Kh., Kazaryan P. A., Avetisyan A. A. - 3-rd
young medics' Intern.Conf. Yerevan. 2005. P. 160.
5. Симонян М. А., Симонян Г. М. - Лицензия изобрет. № 341
Армпатента. Ереван. 1997.
6. Симонян Г. М.,
Симонян Р. М., Симонян М. А. - Лицензия изобрет. № 908 Армпатента,
Ереван. 2001.
7. Nishikimi M., Rao N. A. - Biochem. Biophys. Res. Communs. 1972. V. 64. P.
949-956.
8. Simonyan M. A., Nalbandyan R. M.
- Biochim. Biophys. Acta. 1979. V. 583. P.279-286.
9. Simonyan M. A. - Biochem.
Biophys. Res. Communs. 1982. V. 108. P. 1751-1758.
10. Cимонян М. А., Симонян Р. М., Бабаян М. А. - Мед.
наука Армении. 2003. T. 42. № 1. C. 33-35.
11. Симонян М. А., Карапетян А. В., Бабаян М. А., Симонян Р. М. - Биохимия. 1996. T. 61. № 5. C. 932-941.
12.
Симонян Р. М., Симонян Г. М., Бабаян М. А., Симонян М. А. - Мед. наука Армении. 2004. T. 44. № 1. C. 43-48.
13.
Симонян Р.М. Новые факторы оксидативного
повреждения компонентов крови. Автореф. канд. дис. Ереван. 2004.
14. Fridovich I. - Annu Rev.
Biochem. 1995. V. 64. P. 97-112.
15. Della
R. F., Granata A., Brocco M. - Anticancer. Res. 1995. V. 15. P.
2089-2096.