БИОХИМИЯ
УДК 577.352.4
Г. Г. Саакян, И. Р. Саакян
Регуляторная роль трансаминирования в сукцинатзависимом
поглощении Ca2+ в митохондриях
(Представлено академиком М. А. Давтяном 7/XII 2005)
Ключевые слова: трансаминирование, митохондрии, поглощение Ca2+, окисление
сукцината, регуляция
Известно, что трансаминазные реакции активно
восполняют пул метаболитов цикла Кребса и в свою очередь им контролируются
[1-7]. Стимуляция Ca2+ и H+ [1,5,8-10] a-кетоглутаратдегидрогеназы (КГДГ) - ключевого фермента цикла
Кребса повышает ее сродство к a-кетоглутарату (КГЛ),
субстрату точки разветвления, соединяющей цикл Кребса с метаболизмом
аминокислот. Подавление аминооксиацетатом (АОА) обмена между глутаматом (ГЛУ) и
КГЛ уменьшает поступление в цикл Кребса и сопряженное с синтезом сукцината
окисление КГЛ [1,3,6], а следовательно, продукцию и обеспечение АТP и GТP
эндергонических реакций [1,3-7, 9-13].
В
[12,14,15] нами выявлено реципрокное регуляторное влияние ГЛУ и КГЛ на
поддерживаемое окислением сукцината поглощение Ca2+ в митохондриях.
Подобная регуляция может осуществляться через аспартаттрансаминазную (АСТ)
реакцию с участием оксалацетата (ОАА). В этом плане АСТ может видеться в роли
легко обратимого метаболического звена реципрокной регуляции окисления сукцината
и зависящего от этого окисления транспорта Ca2+.
В настоящей работе исследовано влияние
экзогенных ГЛУ и КГЛ на поддерживаемые окислением сукцината дыхание,
восстановление NАD, поглощение и освобождение Ca2+ из митохондрий
сердца животных с использованием оригинального приема изменения
концентрационного соотношения в диапазоне 1:10 мМ ГЛУ и КГЛ на сукцинатзависимый
транспорт Ca2+. Проведено сравнение действия на этот транспорт КГЛ и
фосфоенолпирувата (ФЕП), известных источников ОАА и GТР, а также исследовано
влияние на процесс ингибитора аминотрансфераз АОА.
Использовали митохондрии сердца собаки, кролика, быка, морской свинки,
крысы, мыши и голубя, а также гомогенаты сердца и печени крыс линии Вистар.
Соотношение ткань - среда для печени 1:1 [16], для сердца - 1:3
[17].
Процедура приготовления, хранения и
отбора гомогенатов сердца и печени подробно описана в [16,17]. Митохондрии
сердца выделяли методом дифференциального центрифугирования (1500 и 12000
оборотов в минуту по 10 мин), используя для этого среду сахарозы 300 мкМ, Нереs
10 мМ, ЭДТА 0,5 мМ, рН 7,4 в соотношении ткань - среда, равном 1:10. Среду
суспендирования (без ЭДТА), модифицированную ГЛУ [17], использовали в
соотношении ткань - среда, равном 10:1. Осадок митохондрий не промывали.
Измерение фосфорилирующего окисления проводили с помощью платинового электрода
полярографическим методом. Измерение окислительно-восстановительного превращения
NАD проводили флуорометрическим методом (366-450 нм). Измерение поглощения
Ca2+ в митохондриях. проводили по противофазному изменению
H+/Ca2+ обмена с помощью водородного электрода.
CaCl2 добавляли порциями до спонтанного выброса из митохондрий
[17,19]. Сумма поглощенных катионов характеризует Ca2+-емкость.
Измерение скорости синтеза АТP из АDP проводили по скорости убыли H+
(защелачиванию среды) после добавления АDР.
Инкубационная среда для выделенных митохондрий сердца содержала 100 мМ
сахарозы, 60 мМ KCl, 1.5 мМ KH2PO4, 1.5 мМ Tris-буфера, рН
7.4; для гомогенатов сердца и печени - 125 мМ KCl, 1 мМ
KH2PO4, 1 мМ Hepes, рН 7.4, t = 25oC. Субстраты
окисления и их концентрации указаны в подписях к рисункам. Митохондрии и
гомогенат вносили в исследуемую среду с заранее добавленным субстратом
окисления. Измерения проводили в течение не более 30-45 мин с момента получения
препаратов. Белок измеряли методом Лоури. Результаты обрабатывали по критерию
Стьюдента и методом парных сравнений( критерий Вилконсона U).
Ограничивающее дыхание
действие a-кетоглутарата при окислении
сукцината. Добавление КГЛ или ГЛУ к митохондриям сердца собаки, кролика,
быка, морской свинки, крысы, мыши и голубя по-разному воздействует на
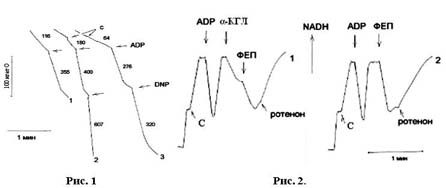
последующее окисление сукцината. На примере дыхания митохондрий сердца собаки
показано (рис. 1), что КГЛ тормозит окисление сукцината (уменьшает
стимулированное АDP и ДНФ дыхание), одновременно повышая эффективность
фосфорилирования: дыхательный контроль (ДК) = 4.1 и АDP/О = 3.3 превышают таковые
(ДК = 3.1 и АDP/О = 2.8) на одном сукцинате. ГЛУ активирует окисление сукцината без
существенного усиления энергетического контроля дыхания: ДК = 3.57, АDP/О = 2.9.
Возможно, влияние КГЛ на окисление сукцината обусловливается синтезом GТP в КГДГ
реакции [18].
|
|
Рис. 1. Ограничение a-кетоглутаратом скорости дыхания на сукцинате в различных
метаболических
состояниях в митохондриях сердца собаки.
Рис. 2. Уменьшение
уровня NАDН при ограничивающем окисление сукцината действии
a-кетоглутарата (1) и фосфоенолпирувата (2) в митохондриях
сердца кролика. Устранение этого
действия ротеноном.
Среда инкубации (рис.1,
2) общим объемом в 1 мл содержит: сахарозы 250 мМ, КС1 30 мМ, KH2
PO4
1.5 мМ, рН 7.5. Субстраты: 1- сукцинат 4 мМ, 2 - ГЛУ 6 мМ, 3 -
КГЛ 6 мМ. Везде АDP добавлена по 200
мкМ, 2.4-динитрофенол - 30 мкМ. Субстраты
добавлены до внесения в среду митохондрий по 1.5 мг.
На рис.2 последовательно
добавлены: 1 - сукцинат 4 мМ, АDP 200 мкМ, КГЛ 10 мМ, ФЕП 1 мМ и
ротенон 2 мкМ;
2 - то же, что и 1, без КГЛ.
Влияние a-кетоглутарата и фосфоенолпирувата на флуоресценцию
генерируемого окислением сукцината NАDН. Из данных рис. 2 видно, что в
митохондриях сердца кролика КГЛ и в заметно большей степени ФЕП уменьшают
исходно высокий уровень восстановленности NАD, поддерживаемый окислением
сукцината. Ротенон устраняет окисляющее действие обоих субстратов. Эти данные
свидетельствуют о сходстве в регуляторном действии КГЛ и ФЕП на окисление
сукцината.
Реципрокность
влияния a-кетоглутарата и глутамата на поддерживаемый
окислением сукцината транспорт Ca2+. Влияние фосфоенолпирувата
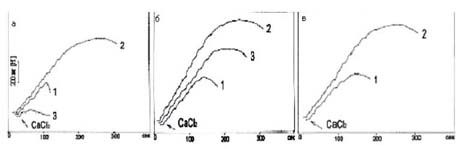
на процесс. Выявлена (табл.1,2, рис.3, а-в) высокая чувствительность
сукцинатзависимого поглощения Ca2+ к изменению концентрационного
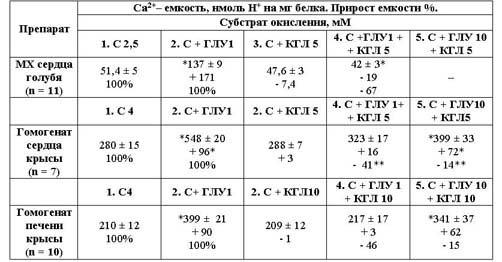
соотношения ГЛУ и КГЛ в пределах 1-10 мМ. КГЛ при концентрационном преобладании
над ГЛУ (10:1) подавляет процесс в сердце голубя на 67%, в сердце и печени крысы
на 41 и 48%, соответственно, и вдвое сокращает (с 3 до 1.5 мин)
продолжительность удержания катиона (рис.3,в). При обратном концентрационном
соотношении ГЛУ к КГЛ, равном 10:1, подавляющее действие КГЛ не выявляется
(рис.3,б). Следует заметить, что с высокими (10:10) концентрациями сравниваемых
субстратов тормозящий эффект КГЛ ослабевает и варьирует между 7-30%. Активация
или торможение процесса зависит от соотношения концентраций исследованных
субстратов. Действие КГЛ и ГЛУ, по-видимому, связано единым реципрокным
механизмом. Взаимодействие между ними осуществляется через реакцию
трансаминирования с участием оксалацетата и аспарагиновой кислоты.
Таблица 1
Устранение a-кетоглутаратом активации
глутаматом сукцинатзависимого
накопления Ca2+ в митохондриях (МХ)
сердца голубя и гомогенатах сердца
и печени крысы
Примечание. % соотнесен к Ca2+
- емкости: на сукцинате (С) для 2, 3 и 4 (вторые строки); на сукцинате и
ГЛУ
(С+ГЛУ) для 4 и 5 (третьи строки). *р = 0.01 к Ca2+ -
емкости с добавленным сукцинатом.
Сходство КГЛ и ФЕП в подавляющем поглощение
Ca2+ действии (табл.2), которое полностью устраняется ГЛУ
(рис.3,б,в), подтверждает предположение о близости механизма действия этих двух
регуляторов на митохондрии.
Выявлена высокая
чувствительность действия ГЛУ к ингибитору трансаминаз - АОА (табл.2), который
снижает стимулированное ГЛУ поглощение Ca2+, индуцирует выброс
катиона. Ингибирующий эффект АОА (59%) превышает таковой КГЛ и ФЕП, но уступает
малонату. Примечательно, что он не устраняется 10 мМ ГЛУ.
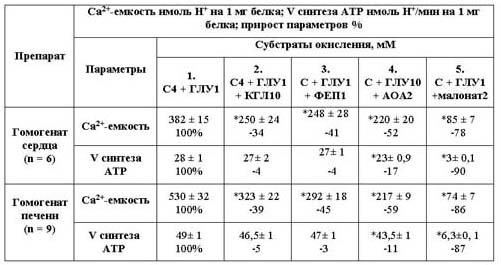
Таблица 2
Устранение a-кетоглутаратом,
фосфоенолпируватом, аминооксиацетатом и
малонатом активации глутаматом
сукцинатзависимого накопления Ca2+ и скорости
синтеза АТP в
гомогенатах сердца и печени крысы
Примечание. % соотнесен к Ca2+ емкости и/или V синтеза АТР на
сукцинате, глутамате 1 и ADP для
2-5.*p=0.01 к параметрам с
добавленным сукцинатом, глутаматом и ADP.
Рис. 3. Реципрокность действия глутамата и a-кетоглутарата на зависимое от окисления сукцината
поглощение Ca2+ в гомогенатах печени у крыс. Устранение a-кетоглутаратом и фосфоенолпируватом
активации глутаматом
поглощения Ca2+. Угнетение процесса малонатом.
Среда инкубации
общим объемом в 2 мл содержит: КС1 125 мМ, Нереs 1 мМ,
KH2PO4 1 мМ, рН 7.5.
Показатели при окислении: а.
сукцината 4мМ - 1, сукцината и ГЛУ 1 мМ - 2, сукцината, ГЛУ и
малоната 2 мМ - 3;
б. сукцината, ГЛУ1 мМ и КГЛ 10 мМ - 1, сукцината, ГЛУ 10 мМ и КГЛ 1мМ - 2,
сукцината, ГЛУ 10 мМ и КГЛ 10 мМ - 3; в. сукцината, ГЛУ 1мМ и ФЕП 1 мМ - 1,
сукцината, ГЛУ 10 мМ
и ФЕП - 2. Добавлен CaCl2 по 100 нмолей.
Действие аминооксиацетата на
скорость синтеза АТP. Из табл.2 явствует, что на гомогенатах сердца и
печени доля подавляющего влияния АОА существенно меньше по параметру синтеза АТP
(11-17%), чем Ca2+-емкости (52-59%). В отдельной серии экспериментов
на сердце исключение из среды гомогенизации ЭДТА приводило к ослаблению ответов
митохондрий на добавленные АDP и Ca2+. Более того, на внесение ADP в
присутствии АОА вместо защелачивания среды наблюдали закисление - смену знака
ответа. Следовательно, в данных условиях проявлялось сильное подавляющее
действие АОА на продукцию и обеспечение АТP поглощения
Ca2+.
Полученные результаты
подтверждают наши предварительные данные [12,14,15] о реципрокности действия КГЛ
и ГЛУ на поддерживаемые окислением сукцината процессы дыхания, восстановления
NАD и поглощения Ca2+ в митохондриях и гомогенатах сердца и печени
различных видов животных. Показано, что ГЛУ активирует дыхание на сукцинате. КГЛ
ограничивает это дыхание и одновременно усиливает его энергетический контроль
(рис.1). Его окисляющее NADH действие усиливается ФЕП и снимается ротеноном
(рис.2). КГЛ и ФЕП устраняют долю активированного ГЛУ сукцинатзависимого
поглощения Ca2+ (рис. 3,б,в). Сходство во влиянии на окисление
сукцината этих двух природных поставщиков ОАА и GТP указывает на общность
механизма их действия. GТР провоцирует ограничение сукцинатзависимого дыхания
[13,18], поглощения Ca2+ [12,16,17], а также высвобождение и переход
катиона из одного внутриклеточного депо в другое [19]. Процесс накопления
Ca2+ преимущественно поддерживается окислением сукцината (рис.3)
[15,16,20,21]. Стимуляция ГЛУ процесса обеспечиваeт повышение
Ca2+-емкости в сердце голубя на 171%, в сердце и печени крысы на 96 и
90%, соответственно (рис.3, табл.1, 2). Малонатом оно полностью устраняется. Как
показано ранее [16], использованная нами концентрация ГЛУ 1 мМ не вносит
существенного вклада в накопление Ca2+, но, по-видимому, оказывается
вполне достаточной для запуска реакции трансаминирования и устранения ОАА,
сильного природного ингибитора активности сукцинатдегидрогеназы. В условиях
концентрационного преобладания (10:1) КГЛ над ГЛУ реализуется тормозящее
накопление Ca2+ действие, которое сменяется противоположным в
условиях преобладания ГЛУ в пределах 1:5 мМ для сердца голубя и крысы и 1:10 мМ
для печени крысы (рис.3, а-в, табл.1, 2).
Рассмотренные данные предполагают индукцию переходов ГЛУ - КГЛ в ответ
на изменение их концентрационных cоотношений [22,7,23], сопровождающихся
сдвигами в содержании ОАА. Конкурентное ингибирование КГЛ активности АСТ [7],
фосфоенолпируваткарбоксикиназы на 43% [24] и других ферментов превращения ОАА
блокирует его утечку. В зависимости от доступности ОАА активность
сукцинатдегидрогеназы может варьировать в широких пределах. Известно, что АСТ с
одной стороны делит цикл Кребса на две отдельные [1,9,25] части, с другой,
замыкая на себя, сопрягает эти части. Высокое содержание АСТ, ее локализация и
прочность связи с внутренней мембраной митохондрий [1,5], ассоциация в
мультиферментный комплекс и работа в "ансамбле" с КГДГ [1,10,22,23] обеспечивают
высокую динамичность и взаимосогласованность превращения субстратов в системе в
целом. Регуляция этого процесса в печени и почке [5], сердце [9,10] реализуется
с участием Ca2+ и H+ [1,5,7,8,9,10,26]. Ca2+
увеличивает сродство КГДГ к ее пусковому субстрату, выступая в роли ведущего
регулятора фермента in vivo [8]. Чувствительность к Ca2+ особенно
высока для пула КГЛ, обеспечиваемого АСТ. Все сказанное подчеркивает ключевую
роль вышеуказанного ферментного комплекса в регуляции и координации потоков
субстратов как между отдельными частями цикла Кребса, так и между митохондриями
и цитоплазмой.
Окисление сукцината
обеспечивает АТР транспорт Ca2+ и опосредованные данным катионом
интенсивные функции (сокращение, секрецию) [1,16,19,25,26,27]. Oграничение
окисления сукцината КГЛ и продуктами его превращения предупреждает чрезмерное
поступление Ca2+ (рис.1-3, табл.1 и 2), перегрузку Ca2+ -
выводящих каналов и инициацию избыточного образования свободных радикалов в
митохондриях. Этим достигается стабильность энергопродуцирующей функции
митохондрий, восполнение фонда АТP и GТP в тканях, поддержание работы органов в
условиях различных физиологических и патологических состояний
[1,5,9-12].
Результаты работы указывают, что
реципрокная регуляция ГЛУ и КГЛ сукцинатзависимого поглощения Ca2+
основывается на интегральном взаимодействии между легко подвижными
трансаминазными реакциями, циклом Кребса и электронотранспортной системой
митохондрий.
Институт теоретической и экспериментальной
биофизики РАН
Литература
1. LaNoue K. F., Tischler M. E. - J. Biol. Chem. 1974. V. 249 (23). P. 7522-7528.
2. Passarella S., Atlante A., Valenti D., de Ban L. - Mitochondrion. 2003. V. 2. P. 319-343.
3. Sanborn T., Gavis W., Berkowitz S., Perille T. - Am. J.
Physiol. 1979. V. 273. P. H535-H541.
4.
Sherry A. D., Zhao P., Wiethoff A. J. - Am. J. Physiol. 1998. V.
274 (43). P. H591-H599.
5. Smith B. C., Clotfelter L. A., Cheung J. Y., LaNoue K. F. - Biochem. J. 1992.
V. 284. P. 819-826.
6. Snaith Ch. D.,
Wright G., Lofkin M. - J. Mol. Cell. Cardiol. 1992. V. 24. P.
305-315.
7. Strzelecki T. Strzelecka D.,
Koch C. D. - Arch.Biochem.Biophys. 1988. V. 264(1). P. 310-320.
8. Nichols B. J., Rigoulet M., and Denton
R. M. - Biochem. J. 1994. V. 303. P. 461-465.
9. O`Donnell J. M., Doumen Ch., LaNoue K.
F. - Am. J. Physiol. 1998. V. 274(43). P. H467-476.
10. Wan P., LaNoue K. F., Cheung J. Y. -
J. Biol. Chem. 1989. V. 264(23). P.
13430-13439.
11. Писаренко О. И., Шульженко
В. С., Студнева И. М. - Кардиология. 2004. N4. С. 65-70.
12. Саакян И. Р. В кн.:
Рецепция и внутриклеточная сигнализация. Пущино. 2003. С. 270 -272.
13. Kondrashova M. N., Doliba N. M. - FEBS Lett. 1989. V. 243. P. 153-155.
14. Саакян И. Р. - В сб.: Терапевтическое действие
янтарной кислоты. Пущино. 1976. С. 201-3.
15. Саакян И. Р. - ДАН АрмССР. 1980. Т. 80. С. 110-116.
16. Caaкян И. Р., Cаакян С. Г., Kондрашова
М. Н. - Биохимия. 2001. Т. 66. С. 976-984.
17. Caaкян И. Р., Шердукалова Л. Ф., Cаакян Г. Г. - Биомед. химия. 2003. Т. 49(5). С. 463-469.
18. Оlson M. S., Allgyer T. T. - J. Biol. Chem. 1973. V.
248(5). P. 1582-1589.
19. Tomas A. P. -
Exp. Med. Biol. 1988. V. 232. P. 197-201.
20. He W., Mlao F J.-P., Lin D. C.-H., Schwandner R. T. - Nature. 2004. V. 429. P. 188-193.
21. Maechler P, Wollheim C. - Nature. 1999. V. 402(9). P.
685-689.
22. Fahien L. A., MacDonald M. J.,
Kmiotek E. H. - J. Biol. Chem. 1988. V. 263(27). P. 13610-14.
23. Teller J. K., Fahien L. A., Valivia E.
- J. Biol. Chem. 1990. V. 265(27). P. 19486-19494.
24. Titheradge M. A., Picking R. A., Haynes
R. C. - Biochem. J. 1992. V. 285. P. 767-771.
25. Кондрашова М. Н. - Биохимия. 1991. T. 56. C. 388-406.
26. Duchen M. - J. Physiol. 1999. V. 516(1). P. 1-17.
27. Lui P. Y., Chan F. l., Suen Y. R. -
J. Biochem. Biophis. Res. Commun. 2003. V. 308. P. 826-833.
28. Rizuto R., Pinton P., Brini M., Chiesa
A. - Cell Calcium. 1999. V. 26(5). P. 193-199.