Результаты комплексного изучения различных биохимических показателей мозга, печени, крови при целом ряде патологий [4] свидетельствуют, что развитие выраженных структурно-функциональных сдвигов в исследованных тканях коррелирует с интенсивностью перекисного окисления липидов (ПОЛ) и состоянием антиоксидантной системы.
Целью настоящей статьи стало изучение особенностей изменения ФЛ-ФЛ соотношений в головном мозге при экспериментальном циррозе печени, a также изучение на фоне цирроза печени особенностей действия тиосульфатa натрия (ТСН) и a-токоферолa (ТФ) в опытах in vivo.
Исследования проводились на 30 беспородных белых крысах-самцах массой 150-200 г, разделенных на шесть экспериментальных групп: I) контрольная группа; II) опытная группа с экспериментальным CCl4-индуцированным циррозом; III) интактные животные, получившие ТФ; IV) опытная группа с экспериментальным CCl4-индуцированным циррозом, получившая ТФ; V) интактные животные, получившие ТСН; VI) опытная группа с экспериментальным CCl4-индуцированным циррозом, получившая ТСН.
В течение 20 дней два раза в неделю опытные группы II, IV и VI внутрибрюшинно получали 0.3 мл CCl4; опытные группы III и IV - 0.4 мг ТФ; опытные группы V и VI - 1 мл ТСН и группа I - 1 мл физиологического раствора.
Животных декапитировали под легким наркозом, мозг быстро извлекали, охлаждали и отмывали от крови в изотоническом растворе NaCl, на холоду освобождали от оболочек и кровеносных сосудов. После многократной экстракции фосфолипидов хлороформ-метаноловой смесью из заранее приготовленных ацетоновых порошков головного мозга [5] производили их фракционирование в тонком слое силикагеля на пластинах фирмы "Мерк" (Германия) в системе растворителей хлороформ:метанол:аммиак (65:35:5).
Идентификацию хроматографических пятен индивидуальных ФЛ производили с помощью стандартов ("Sigma", США) в атмосфере, насыщенной парами йода. Количество ФЛ выражали в мг липидного фосфора, минерализованного сжиганием проб ФЛ в смеси концентрированных серной и азотной кислот в песочной бане при 180-20oC до состояния прозрачности, с последующим расчетом количества неорганического фосфора, определяемого по цветной реакции молибденовокислого аммония с витамином C [6]. Белок определяли по Лоури и соавт. [7]. Полученные результаты были обработаны методом вариационной статистики с использованием критерия Стъюдента [8].
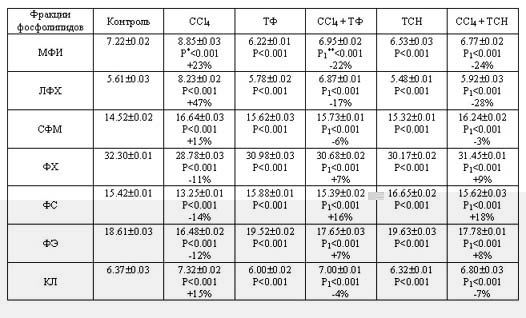
Относительные содержания индивидуальных ФЛ в ткани головного мозга белых крыс в норме при CCl4-индуцированном циррозе печени, а также при применении ТФ и ТСН на фоне болезни представлены в таблице.
Анализ полученных результатов свидетельствует о значительных качественных и количественных изменениях в фосфолипидном составе изученных образцов. Количество лизофосфатидилхолинов (ЛФХ) в головном мозге больных животных увеличилось на 47%, что может быть результатом чувствительной интенсификации процессов деацилирования фосфатидилхолинов (ФХ), характеризующихся также образованием высокого пула неэстерифицированных жирных кислот, вступающих в окислительные процессы, связанные с активацией ПОЛ и образованием малонового деальдегида (МДА).
Снижение содержания ФХ (11%) сопровождается одновременным уменьшением количеств фосфатидилсеринов (ФС) и фосфатидилэтаноламинов (ФЭ) (14 и 12% соответственно). Значение последних в катализе реакций окисления и поддержании дыхательной функции митохондрий едва ли можно переоценить. Антиокислительная смесь ФХ, полученная из сои, восстанавливает фосфолипиды поврежденных мембран и активирует их ферменты, включая фосфатидилэтаноламин метилтрансферазу [9, 10]. Уменьшение содержания ФХ, ФС и ФЭ одновременно может быть связано с тем, что они наиболее быстрo подвергаются окислению свободными радикалами при усилении процессов ПОЛ.
Настораживающим при CCl4-индуцированном циррозе печени является и наблюдающееся увеличение таких относительно медленно обменивающихся ФЛ головного мозга, каковыми являются сфингомиелины (СФМ) - главные липидные компоненты миелиновой фракции. Так как СФМ - обычно очень насыщенный липид, не содержащий полиеновые кислоты, повышенное количество этих липидов приводит к выраженной жесткости мембран, т.е. к увеличению микровязкости липидной фазы мембран, что, в частности, характеризуется угнетением активности Na,K-ATP-5 нуклеотидазы [11].
Содержание кардиолипинов (КЛ) в головном мозге невелико, однако нельзя игнорировать чувствительное повышение содержания этого липида, который вместе с ФС и монофосфоинозитидами (МФИ) обеспечивает необходимый уровень гидрофобности, следовательно, и липидзависимости ряда митохондриальных ферментов, катализирующих реакции электронтранспортирующей цепи в отмеченных субфракциях клеток и дыхательной функции клеток в целом. Как известно, КЛ являются носителями отрицательного заряда, следовательно, они способны выполнять ионофорную функцию, в том числе влиять на транспорт Ca2+ и Na+.
Выявлен также факт повышенного содержания МФИ. В крови содержание МФИ при CCl4-индуцированном циррозе было понижено [12], а в головном мозге - наоборот, повышено (на 23%). Это связано с тем, что МФИ участвуют в так называемом фосфатозитидном цикле [13], который отвечает за синаптическую передачу нервных импульсов [14].
Описанные сдвиги в известной степени отражают характер ответной реакции организма на комплекс патогенетических сигналов, поступающих из очага поражения. Следовательно, противоположная направленность количественных изменений нейтральных и кислых ФЛ в исследованных биологических системах может быть интерпретирована как адекватная для данной патологии специфическая ответная реакция организма.
Введение животным ТФ и ТСН сопровождается заметным нивелированием расстройств, что отражается в количественном содержании всех исследованных категорий ФЛ головного мозга белых крыс при CCl4-индуцированном циррозе печени: в частности ЛФХ, СФМ, ФХ, ФЭ и КЛ проявили тенденцию к нормализации, а нормализация количественных сдвигов МФИ и ФС достигла 100%. Констатировано, что ТСН является более эффективным корректором метаболизма ФЛ головного мозга, нежели ТФ, хотя в случае СФМ ТФ эффективнее.
Обобщение полученных результатов позволяет говорить о возможной патогенетической роли нарушения метаболизма важнейших компонентов липидного бислоя, что, безусловно, приводит к нарушению функциональной активности мембранных структур клеток при данной патологии, а также о высокой эффективности применения ТФ и ТСН в случае CCl4-индуцированногo циррозa.
Содержание индивидуальных представителей фосфолипидов (в %
от общей
суммы) в головном мозге при CCl4-индуцированном циррозе
печени под
воздействием ТФ и ТСН
|
|
*P - в сравнении с контролем; **P1 - в сравнении с получившей CCl4 группой.