БИОХИМИЯ
УДК 577.612.01
Р. М. Симонян, Г. М. Симонян, М. А. Симонян
Ингибирование цитохромом b558III супероксид-продуцирующей
активности супрола и ее стимулирование
тетрахлором углерода in vitro
(Представлено академиком М. А. Давтянoм 16/III 2005)
Супероксид-продуцирующий липопротеин - супрол
локализован в сыворотке крови млекопитающих [1] и рыб [2] и является
липопротеином высокой плотности, продуцирующим супероксидные радикалы
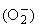 в присутствии следов ионов
переходных металлов (Fe+3, Cu+2) in vitro и in vivo [3].
Это имеет место, в частности, при интоксикации крыс ионами переходных металлов
[4,5], а также при сердечно-сосудистых заболеваниях [6]. Продуцированные
в присутствии следов ионов
переходных металлов (Fe+3, Cu+2) in vitro и in vivo [3].
Это имеет место, в частности, при интоксикации крыс ионами переходных металлов
[4,5], а также при сердечно-сосудистых заболеваниях [6]. Продуцированные
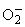 и их производные
(1O2, H2O2, HO·, NO· и др.)
инициируют перекисное окисление фосфолипидных остатков самого супрола, вызывая
агрегацию супрола. Это, в свою очередь, может изменить вязкость крови и
воздействовать на гемодинамику и тромбообразование [7]. Супрол продуцирует
и их производные
(1O2, H2O2, HO·, NO· и др.)
инициируют перекисное окисление фосфолипидных остатков самого супрола, вызывая
агрегацию супрола. Это, в свою очередь, может изменить вязкость крови и
воздействовать на гемодинамику и тромбообразование [7]. Супрол продуцирует
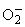 в течение сравнительно
долгого времени (5-6 ч) в аэробных условиях in vitro, в отличие от других
в течение сравнительно
долгого времени (5-6 ч) в аэробных условиях in vitro, в отличие от других
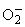 -продуцирующих систем [7]. При
этом продуцированные
-продуцирующих систем [7]. При
этом продуцированные
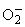 нормально дисмутируются антиоксидантными препаратами различного характера [7].
Обнаружение биологических средств, ингибирующих продуцирование
нормально дисмутируются антиоксидантными препаратами различного характера [7].
Обнаружение биологических средств, ингибирующих продуцирование
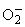 супролом, может иметь важное
значение для стабилизации или предотвращения агрерации супрола. По
предварительным результатам супрол продуцирует
супролом, может иметь важное
значение для стабилизации или предотвращения агрерации супрола. По
предварительным результатам супрол продуцирует
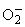 и в присутствии следов "связанного" железа (например,
железа гемовой группы гемоглобина), а цитохром (цит) b558III обладает
способностью образовывать нестабильный комплекс с метгемоглобином (метHb) за
счет NO·, присутствующего в гемовой группе
цит b558III как 5-й или 6-й лиганд железа [8]. Целью работы явилось определение
характера воздействия цит b558III и CCl4 на супероксид-продуцирующую
активность супрола in vitro
и в присутствии следов "связанного" железа (например,
железа гемовой группы гемоглобина), а цитохром (цит) b558III обладает
способностью образовывать нестабильный комплекс с метгемоглобином (метHb) за
счет NO·, присутствующего в гемовой группе
цит b558III как 5-й или 6-й лиганд железа [8]. Целью работы явилось определение
характера воздействия цит b558III и CCl4 на супероксид-продуцирующую
активность супрола in vitro
Цит b558III из
эритроцитарных мембран (ЭМ) и супрол из сыворотки крови крыс получали
биотехнологическим способом [9], без использования детергента [10]. При этом цит
b558III получается в электрофоретически гомогенном состоянии, а супрол содержит
небольшие следы гемопротеина (Hb). Активирование супрола (для продуцирования
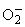 ) осуществляли следами ионов
Fe+3 [3].
) осуществляли следами ионов
Fe+3 [3].
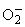 -продуцирующую активность супрола и цит b558III
определяли нитротетразолиевым синим (НТС) методом [9], рассчитав проценты
повышения плотности максимального оптического поглощения формазана (при 560 нм),
образовавшегося в результате восстановления НТС супероксидными радикалами. За
единицу
-продуцирующую активность супрола и цит b558III
определяли нитротетразолиевым синим (НТС) методом [9], рассчитав проценты
повышения плотности максимального оптического поглощения формазана (при 560 нм),
образовавшегося в результате восстановления НТС супероксидными радикалами. За
единицу
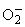 - продуцирующей
активности супрола или цит b558III принимали количество белка, вызывающее
50%-ное увеличение плотности поглощения формазана. Удельная
- продуцирующей
активности супрола или цит b558III принимали количество белка, вызывающее
50%-ное увеличение плотности поглощения формазана. Удельная
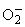 - продуцирующая активность
супрола и цит b558III была определена в расчете на 1 мл сыворотки и эритроцитов
соответственно.
- продуцирующая активность
супрола и цит b558III была определена в расчете на 1 мл сыворотки и эритроцитов
соответственно.
Оптические спектры
поглощения регистрировали на спектрофотометре ''Specord UV/VIS'' (Германия) с
длиной оптического пути 1 см при 20o.
Статистическую обработку полученных результатов осуществляли методом
вариационной статистики Стьюдента-Фишера, с расчетом критерия достоверности
P.
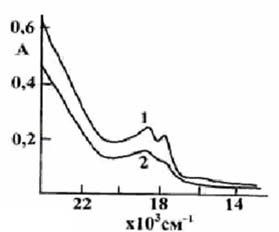
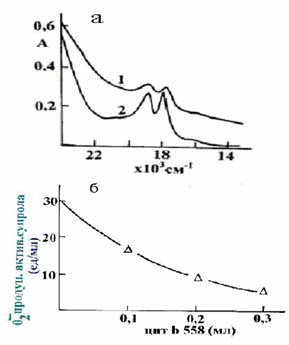
В результате небольшого гемолиза
эритроцитов (наблюдающегося при декапитировании крыс) супрол образует
нестабильное комплексное соединение с метHb (рис.1,1). После активирования
такого супрола ионами Fe+3 форма его оптического спектра не
изменяется. При этом на спектре видны характерные максимальные поглощения Hb
(альфа- и бетта-полосы поглощения).
|
|
Рис.1.
После агрегации (самоосаждения)
супрола в результате инкубирования при 4o в течение 40-50 ч в
аэробных условиях и центрифугирования его осадoк имеет красноватый цвет, а
супернатант бесцветный. Это свидетельствует о том, что Hb действительно входит в
комплексное соединение с супролом. После гомогенизации в 0.04 М калий фосфатном
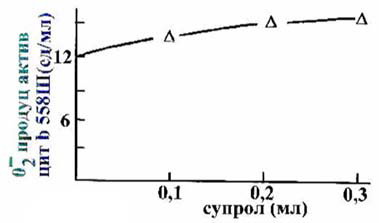
буфере (КФБ) осадка агрегированного с Hb супрола смесь проявляет
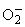 - продуцирующую активность
(рис.2). Под влиянием добавленного цит b558III (A530 = 0.2) наблюдается
снижение (60.5±6.4%, n = 6, P < 0.05)
- продуцирующую активность
(рис.2). Под влиянием добавленного цит b558III (A530 = 0.2) наблюдается
снижение (60.5±6.4%, n = 6, P < 0.05)
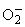 - продуцирующей активности
супрола с A430 = 0.02 в реакционной смеси. В результате его
инкубирования (в течение 20-30 мин) с цит b558III при 20o наблюдается
отщепление Hb от супрола и присоединение его к цит b558III.
- продуцирующей активности
супрола с A430 = 0.02 в реакционной смеси. В результате его
инкубирования (в течение 20-30 мин) с цит b558III при 20o наблюдается
отщепление Hb от супрола и присоединение его к цит b558III.
Рис.2.
При этом осадок агрегированного
супрола теряет красный цвет, а супернатант (комплекс цит b558III с Hb)
представляет из себя раствор красноватого цвета. Спектр этого раствора имеет
смешанную форму спектров Hb и цит b558III, что харктерно для комплекса Hb с цит
b558III [11] (рис.3).
Рис.3.
НАДРН-зависимая
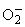 -продуцирующая активность
комплекса цит b558III с Нb на 20-30% выше таковой у цит b558III (рис.4, а).
Bидимо, в этом состоянии Hb, как ионы переходных металлов, служит переносчиком
электрона от НАДРН (группа в молекуле супрола) к молекулярному кислороду,
превращая его в
-продуцирующая активность
комплекса цит b558III с Нb на 20-30% выше таковой у цит b558III (рис.4, а).
Bидимо, в этом состоянии Hb, как ионы переходных металлов, служит переносчиком
электрона от НАДРН (группа в молекуле супрола) к молекулярному кислороду,
превращая его в
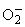 [3]. Цит
b558III входит в комплексное соединение с отщепленным от супрола Hb, в
результате чего происходит дезактивирование супрола. Одновременно несколько
повышается
[3]. Цит
b558III входит в комплексное соединение с отщепленным от супрола Hb, в
результате чего происходит дезактивирование супрола. Одновременно несколько
повышается
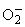 -продуцирующая
активность цит b558III. Фактически цит b558III очищает супрол от следов Hb и
дезактивирyет этот липопротеин сыворотки высокой плотности, повышая его
стабильность. Таким образом, проявляется "антиоксидантный" эффект цит b558III,
предотвращающий продуцирование
-продуцирующая
активность цит b558III. Фактически цит b558III очищает супрол от следов Hb и
дезактивирyет этот липопротеин сыворотки высокой плотности, повышая его
стабильность. Таким образом, проявляется "антиоксидантный" эффект цит b558III,
предотвращающий продуцирование
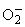 супролом и подавляющий перекисное окисление
фосфолипидных остатков супрола супероксидными радикалами. Это имеет большое
значение для сохранения стабильности супрола, соответственно и нормальной
вязкости сыворотки.
супролом и подавляющий перекисное окисление
фосфолипидных остатков супрола супероксидными радикалами. Это имеет большое
значение для сохранения стабильности супрола, соответственно и нормальной
вязкости сыворотки.
Рис.4.
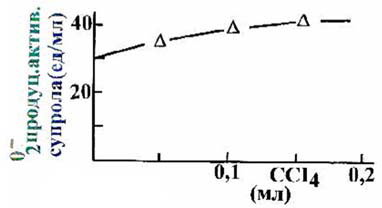
Под
воздействием CCl4 (рис 4, б) наблюдается повышение
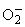 - продуцирующей активности
супрола (31.4±3.2%, P < 0.03), что, возможно,
связано с повышением "растворимости" супрола как липопротеина высокой плотности
в гидрофобной среде CCl4. Видимо, на начальных этапах
экспериментального цирроза печени крыс под воздействием CCl4
происходит повышение
- продуцирующей активности
супрола (31.4±3.2%, P < 0.03), что, возможно,
связано с повышением "растворимости" супрола как липопротеина высокой плотности
в гидрофобной среде CCl4. Видимо, на начальных этапах
экспериментального цирроза печени крыс под воздействием CCl4
происходит повышение
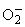 -продуцирующей активности и липидной пероксидации
супрола с соответственным повышением вязкости сыворотки и возможным изменением
гемодинамики. Эти обстоятельства вынуждают переоценить токсические эффекты
CCl4. С другой стороны, подавление
-продуцирующей активности и липидной пероксидации
супрола с соответственным повышением вязкости сыворотки и возможным изменением
гемодинамики. Эти обстоятельства вынуждают переоценить токсические эффекты
CCl4. С другой стороны, подавление
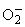 -продуцирующей активности супрола, расщепление
комплекса супрола с Нb и захват последнего цитохромом b558III являются новыми
факторами "очищения" сыворотки, повышения стабильности липопротеина сыворотки
высокой плотности - супрола и сохранения нормальной вязкости крови в целом.
Исходя из того, что цит b558III локализован на внешней поверхности ЭМ [11], не
исключается аналогичная роль цит b558III и в гетерогенной фазе (в ЭМ).
-продуцирующей активности супрола, расщепление
комплекса супрола с Нb и захват последнего цитохромом b558III являются новыми
факторами "очищения" сыворотки, повышения стабильности липопротеина сыворотки
высокой плотности - супрола и сохранения нормальной вязкости крови в целом.
Исходя из того, что цит b558III локализован на внешней поверхности ЭМ [11], не
исключается аналогичная роль цит b558III и в гетерогенной фазе (в ЭМ).
Институт биохимии им. Г. X. Бунятяна НАН РА
Литература
1. Симонян М. А., Карапетян А. В., Бабаян М.
А., Симонян М. А. - Биохимия. 1996. Т. 61. № 5. С. 932-938.
2. Симонян Г. М., Симонян М. А., Карагезян
К. Г. - ДНАН Армении. 2003. Т. 103. № 2. С. 151-153.
3. Симонян Г. М., Бабаян М. А., Симонян Р.
М., Симонян М. А. - Биол. ж. Армении. 1999. Т. 1. № 52. С.
18-21.
4. Оксузян Г. Р., Симонян Р. М.,
Симонян М. А., Алексанян С. С. - Мед. наука Армении. 2001. Т. 41.
№ 2. С. 21-26.
5. Оксузян Г. Р., Симонян Р.
М., Бабаян М. А., Симонян М. А. - Мед. наука Армении. 2002. T. 42.
№ 2. С. 3-6.
6. Алексанян Серг. С.,
Алексанян С. С., Симонян Г. М. - Вестник МАНЭБ Санкт-Петербурга.
2004. Т. 9. № 8. С. 198-200.
7. Симонян Р.
М., Симонян Г. М., Симонян М. А. - Вестник МАНЭБ Санкт-Петербурга.
2004. Т. 9. № 8. С. 72-79.
8. Симонян Р. М. Новые факторы оксидативного повреждения компонентов крови.
Автореф. канд. дис. Ин-т биохимии НАН РА. Ереван. 2004.
9. Симонян М. А., Симонян Г. М. Способ получения
металлопротеинов крови. Лицензия изобрет. № 341 Армпатента. Ереван. 1997.
10. Симонян М. А., Симонян Г. М., Симонян
Р. М. Способ получения цитохромов b из мембран эритроцитов.
Лицензия № 908 Армпатента. Ереван. 2001.
11.
Симонян Г. М., Симонян Р. М., Бабаян М. А., Карапетян А. В., Симонян М. А. -
Мед. наука Армении. 2003. Т. 43, № 1. С. 30-38.