Как известно, одним из основных патогенетических факторов, стимулирующих процесс развития гипергликемической реакции организма, является расстройство процессов трансмембранного переноса глюкозы во внутриклеточное пространство, которые регулируются инсулином. Согласно литературным данным, помимо последнего аналогичным действием обладают также фосфолипазы "А" и "С", проявляющие высокий уровень специфичности в отношении мембраносвязанных фосфолипидов. Oдним из ярких проявлений расстройств реакций тканевого метаболизма при сахарном диабете является интенсификация процессов свободнорадикального окисления липидов, поддерживаемая в физиологически метаболизирующем организме в пределах строго лимитированных границ, что обеспечивается благодаря активно регулируемому балансу в норме двух контрсистем - механизмов про- и антиоксидантного действия. Существенная роль при этом отводится компонентам эндогенной системы антирадикальной защиты клетки [4,5]. Срыв отмеченного динамического равновесия между указанными системами, имеющими прямое отношение к интенсификации или нивелированию активности перекисеобразовательного процесса [3,6,7], выступает в роли основного решающего фактора в изменении физико-химических свойств биологической мембраны, ее жидкостности или текучести, ответственных за функциональную активность локализованных в ней многочисленных ферментов, катализирующих реакции трансмембранной передачи продуктов питания, а также трансдукции внешнего сигнала внутрь клетки [8]. Согласно указаниям литературы последних лет, основное назначение инсулина состоит не только в его адекватном комплексовании с соответствующими специфическими рецепторами, но и с фосфолипидами, локализованными в данном сегменте мембраны.
Исходя из вышеизложенного представляло существенный интерес изучение особенностей межфракционных изменений индивидуальных представителей фосфолипидов в различных биологических системах организма, в частности в мозговой, печеночной и миокардиальной тканях, при экспериментальном сахарном диабете, моделированном аллоксаном, под воздействием разработанного нами биологически активного вещества, что и стало предметом исследований в настоящей работе. Основной акцент был поставлен на. выявлении и изучении в деталях антидиабетических эффектов экстрактов из белковой железы представителей беспозвоночных животных.
Моделирование сахарного диабета было проведено на беспородных белых крысах-самцах массой 170-200 г одноразовым введением им аллоксана из расчета 15 мг/100 г массы тела с содержанием их в обычных условиях вивария. Животные были подразделены на следующие группы: 1) интактные, 2) аллоксандиабетические, 5) аллоксандиабетические с 4-кратным введением им (через каждые 3 дня) 1 мл указанного экстракта, 4) аллоксандиабетические с 7-кратным введением им (через каждые 3 дня) 1 мл указанного экстракта. Показателем развития стойкой картины сахарного диабета служило установление высокого уровня гипергликемической кривой. Развитие картины ярко выраженного аллоксанового диабета констатировалось на 12-14 день после введения аллоксана. Животных забивали декапитированием под легким эфирным наркозом. Головной мозг, печень и сердце изолировали в условиях холодовой комнаты в максимально ограниченное время с освобождением их от оболочек и кровеносных сосудов, при тщательном промывании охлажденным физиологическим раствором.
Экстракцию тканевых фосфолипидов из указанных органов осуществляли по Фолчу [9] в модификации Карагезяна [10]. Фракционирование индивидуальных представителей фосфолипидов производили методом одномерной восходящей хроматографии в тонком слое силикагеля (пластинки "Меrсk", Германия) с использованием чистых стандартов фосфолипидов производства "Sigma" (США) в системе растворителей хлороформ:метанол:концетрированный аммиак. Содержание фосфолипидов в мкг липидного фосфора пересчитывали на 1 мг белка, на 1 г свежей ткани или высушенного ацетонового порошка исследуемой ткани [11].
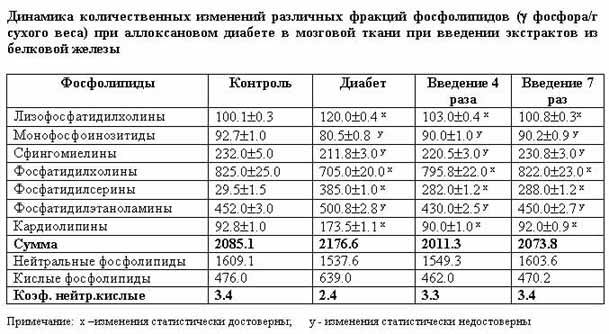
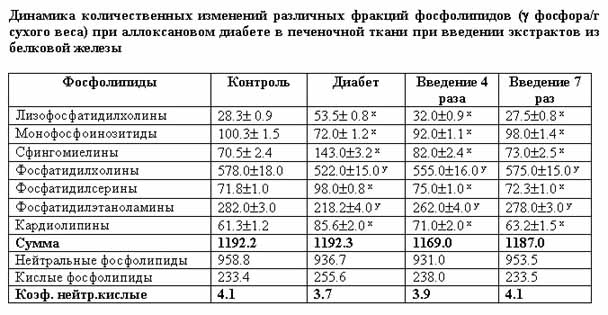
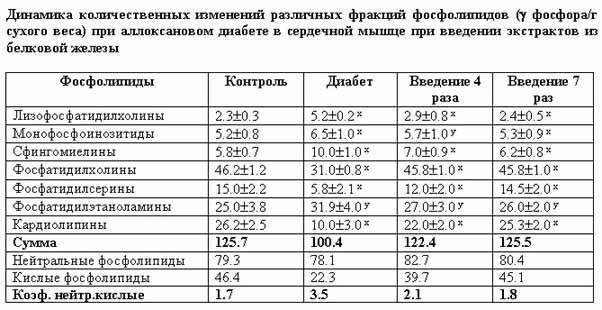
Как показали результаты проведенных исследований, аллоксановый диабет сопровождается существенными расстройствами филогенетически стабилизированного постоянства фосфолипид-фосфолипидных соотношений в изученных биологических системах организма. Эти сдвиги характеризуются значительным увеличением количественного содержания кислых фосфолипидов, известных высоким уровнем метаболической активности, в частности, в плане поддержания функциональной активности различных мембраносвязанных ферментных комплексов (табл. 1, 2, 3). Отмечается значительное возрастание уровня лизофосфатидилхолинов - продуктов деацилирования фосфатидилхолинов.
Как вытекает из результатов, приведенных в табл. 1, 2, в мозговой и печеночной тканях аллоксандиабетических белых крыс обнаруживается чувствительное возрастание содержания кардиолипинов, что мы склонны интерпретировать как проявление компенсаторно-приспособительной реакции организма в создавшихся для него необычных экстремальных условиях существования. Кардиолипины имеют большое значение в регуляции ферментных систем, катализирующих реакции транспорта электронов на уровне внутренних мембран митохондрий и протекающих в них процессов дыхания.
Таблица 1
|
|
Разрушительное действие токсикоза сахарного
диабета проявляется и в виде количественного возрастания в исследованных тканях
сфингомиелинов (табл.2) как факторов, способствующих повышению фактора тканевой
регидности. С другой стороны, отмеченный сдвиг по современным представлениям
следует расценивать и как явление положительное, поскольку согласно работам
Бергельсона и Дятловицкой, указанная категория фосфолипидов играет существенную
роль в повышении иммунологического статуса организма, что особенно важно в
условиях патологии.
Таблица 2
|
|
Таблица 3
|
|
Сравнительная оценка количественных сдвигов
отдельных представителей фосфолипидов во всех исследованных нами тканях
позволяет прийти к заключению об активировании в них при аллоксановом диабете
фосфолипазы А2, сопровождающемся выходом высоких концентраций
лизофосфатидилхолинов, что является результатом деацилирования
фосфатидилхолинов, сопровождающегося одновременным увеличением количества
фосфатидилсеринов. Анализ полученных данных свидетельствуют об активировании в
патологически изменившихся тканях процессов взаимопревращений фосфатидилсеринов,
фосфатидилэтаноламинов и фосфатидилхолинов. В основе этих процессов лeжит
процесс декарбоксилирования фосфатидилсеринов с трансформацией их в
фосфатидилэтаноламин и последних в фосфатидилхолин на фоне интенсифицированных
реакций метилирования. Однако при этом вместо ожидаемого повышения содержания
фосфатидилхолинов констатировалось их уменьшение, что логически объясняется
чрезмерным активированием фосфолипазы А2, деацилирующей
фосфатидилхолин с образованием высокого пула лизофосфатидилхолинов.
Примечательно, что уровень последних, как правило, является обязательным
патогенетическим показателем в исследованных тканях при сахарном
диабете.
Особого внимания заслуживают
количественные сдвиги в исследованных тканях монофосфоинозитидов. Содержание
этой категории фосфолипидов в мозговой и печеночной тканях статистически
достоверно уменьшается по сравнению с контрольными показателями, а в
миокардиальной ткани увеличивается (табл.3). Полученные результаты позволяют
по-разному интерпретировать участие монофосфатидилинозитидов в регуляции
мессенджерной функции этих липидов в изученных функционально различных тканях.
После введения аллоксана на 14 день
количество глюкозы колебалось в пределах 8.2-9.3 ммоль/л. При 4-кратном введении
экстракта определяли количество глюкозы на 18 день - 6.0-6.5 м моль/л и на 24
день - 5.6-6.0 м моль/л. В последней серии при 7-кратном введении определяли
количество глюкозы на 20 день - 5.6-6.5 м моль/л и на 29 день - 5.0-5.6 ммоль/л.
Эти данные говорят о том, что экстракт из белковой железы обладает эффективным
лечебным действием при аллоксановом диабете. 4- и 7-кратное применение
экстрактов белковой железы моллюсков продемонстрировало нормализующее действие
активных начал, присутствующих в указанном экстракте, на нарушение метаболизма
фосфолипидов в мозговой, печеночной и миокардиальной тканях
аллоксандиабетических белых крыс.
Результаты
проведенных исследований создают предпосылки для поиска путей по расшифровке
качественного состава биологически активных соединений в составе экстракта из
белковой железы.
Работа выполнена при
финансовой поддержке Международного научно-техническoгo фонда по проекту
NА-676.
Институт мoлекyлярной биoлoгии НАН
РА
Литература
1. Giugliano D., Ceriello A. - Diabetes Care. 1996. V. 19. P. 257-267.
2. Hink U., Li H., Mollnau H., Oelze M., Matheis E., Hartmann M., Skatchkov
M., Thaiss F., Stahl, R. A., Warnholtz A., Meinertz T., Griendling K., Harrison
D. G., Forstermann U. - Munzel TCirc. Res. 2001. V. 88. P.
EI4-E22.
3. Karasu C. - Eur.
J. Pharmacol. 2000. V. 392. P. 163-173.
4. Бурлакова Е. Б., Джалябова М. И. B кн.: Биоантиокислители
в регуляции метаболизма в норме и патологии. М. 1982. С. 113-141.
5. Stefek M., Sotnikova R., Okruhlicova L.,
Volkovova K., Kucharski J., Gajdosik A., Gajdosikova A., Mihalova D., Hozova R.,
Tribulova N., Gvozdjakova A. - Acta Diabetol. 2000. V. 37. P.
111-117.
6. Kocak G., Aktan F., Canbotat
O., Ozogul C., Elbeg S., Yildizoglu-Ari N., Karasu C. - Diabetes
Nutr. Metab. 2000. V. 13. P. 308-319.
7. Sotnikova R., Stefek M., Okruhlicova L., Navarova J., Bauer V., Gajdosik
A., Gajdosikova A. - Methods Find. Exp. Clin. Pharmacol. 2001. V.
23. P. 121-129.
8. Tадевосян Ю. В. - Pоль процессов кооперативной модификации липидного компонента мембран в
регуляции клеточной активности. Автореф. докт. дис. Ереван. 1996.
9. Folch J., Lees M., Sloane-Stane G. J. -
Biol. Chem. 1957. V. 226. P. 497-509.
10.
Карагезян К. Г. - Лабораторное дело. 1969. С. 3-5.
11. Lowry O. H., Zopez J. A. - J. Biol. Chem. 1946. V. 162. P. 421.