УДК 577.112.612
Дыхание иммунных клеток и митохондрий мозга на
аминокислотных
субстратах
(Представлено академиком А. А. Галояном 22/IV 2004)
Известно, что аминокислоты семейства
глутамина синтезируются из глюкозы и могут в условиях ее дефицита служить в
качестве субстратов дыхания в митохондриях мозга. В то же время имеются данные о
плохой проницаемости митохондрий мозга в отношении основного аминокислотного
субстрата глутамата [1, 2], который, по-видимому, в основном захватывается
цитоплазматическими везикулами, запасающими и транспортирующими его в нервные
окончания. Основным источником трансмиттерного глутамата в мозге служит
глутамин, превращение которого в глутамат и аммиак обеспечивается локализованной
на наружной стенке внутренней митохондриальной мембраны нейронов
фосфатактивируемой глутаминазой (ФАГ). Kонцепция компартментализации обмена
нейротрансмиттерных аминокислот, глутамата и ГАМК в мозге объясняет ряд
особенностей их метаболизма, связанных с множественностью путей обмена и функций
[3-6]. Согласно концепции глутамин-глутаматного цикла медиаторный глутамат,
захваченный глиальными клетками, превращается в глутамин, транспортируется в
нейроны, где и подвергается действию ФАГ. Если большая часть глутамата
захватывается цитоплазматическими везикулами, то аммиак, скорее всего, проникает
в митохондрии [7], где используется в синтезе глутамата, регулируя одновременно
через глутаматдегидрогеназную реакцию интенсивность функционирования цикла
Кребса. Вместе с тем ряд данных свидетельствует о возможности использования
глутамина в качестве топлива энтероцитами, спленоцитами, лимфоцитами и
нейтрофилами [8-10]. Однако такая возможность связывается с интенсивным
глутаминолизом, без учета окисления образующегося глутамата. Дыхание указанных
клеток на аминокислотных субстратах мало исследовано, что побудило нас провести
сравнительное изучение возможности их окисления митохондриями мозга, тимоцитами
и спленоцитами.
Опыты проведены на белых
крысах обоего пола, содержавшихся в условиях вивария Института биохимии НАН РА.
Крыс обезглавливали под легким эфирным наркозом, быстро удаляли мозг, тимус и
селезенку, промывали холодным раствором Трис-сахарозы, удаляли оболочки и
гомогенизировали в соответствующих средах. Митохондрии мозга выделяли по
Палладину и Кирсенко [11]. Белок определяли по Лоури [12]. Для получения
тимоцитов и спленоцитов использовали охлажденную до 4oС
модифицированную среду Хенкса, содержащую до 5.12 x 10-2 г/л Са2+ [13]. Дыхание митохондрий
регистрировали с помощью аппарата "BAS-100" (USA) с использованием электрода
Кларка. Инкубационная среда для выделенных митохондрий мозга содержала: 100 мМ
сахарозы, 60 мМ КС1, 1.5 мМ КН2РО4, 1.5 мМ Tрис-буфера, рН
7.4; для тимоцитов и спленоцитов - 120 мМ КСl, 1 мМ
КН2РО4, 1 мМ Hepes, рН 7.4, t = 37oC. Субстраты
окисления с концентрациями указаны в подписях к рисункам. Везде АДФ добавляли по
200 мкМ.
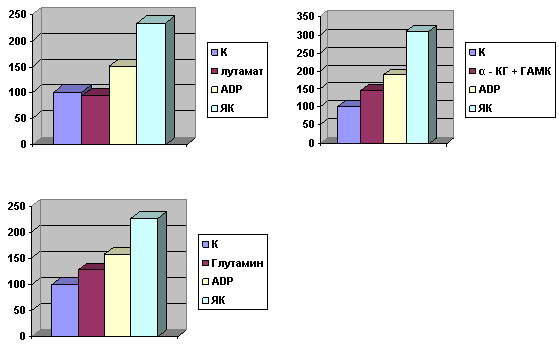
Результаты изучения дыхания
митохондрий мозга на аминокислотных субстратах представлены на рис. 1.
|
|
Рис.1. Дыхание митохондрий мозга на аминокислотных
субстратах. Концентрация субстратов 5мМ.
Скорость эндогенного дыхания
2.6x10-8 М мин-1. мг-1 белка
Как видно из рисунка, добавление глутамата к
митохондриям почти не влияет на уровень эндогенного дыхания. Дыхание на
глутамате при добавлении универсального активатора окисления - акцептора фосфата
АДФ усиливается на 65% по сравнению с пробой, содержащей глутамат в фосфатном
буфере. Добавление янтарной кислоты в состоянии 3 дыхательной цепи приводит к
усилению уровня поглощения кислорода до 90%, что свидетельствует о нормальном
функционировании митохондрий и о том, что янтарная кислота является лучшим
энергетическим субстратом митохондрий.
Интересно, что глутамин в отличие от глутамата повышает уровень
эндогенного дыхания, что, скорее всего, связано с большей проницаемостью
митохондрий для амида. Вместе с тем при активации дыхания АДФ суммарное
поглощение кислорода на глутамате и его амиде одинаково, т.е. АДФ усиливает
дыхание на глутамате в большей степени, чем на глутамине.
Более высокий уровень поглощения кислорода
отмечается при совместном добавлении к митохондриям a-кетоглутарата и ГАМК (+ 45% от эндогенного дыхания),
который возрастает примерно на столько же при добавлении в среду АДФ.
|
|
Рис. 2. Дыхание тимоцитов на аминокислотных субстратах.
Концентрация субстратов: глутамин -
15 мМ, глутамат, ГАМК и кетоглутарат - 10
мМ, сукцинат - 6 мМ. Скорость эндогенного дыхания -
6.8
нМ.мин-1. мг-1 белка
На рис. 2 и 3 представлены результаты
изучения дыхания на аминокислотных субстратах тимоцитов и спленоцитов.
Спленоциты дышат на глутамине заметно лучше тимоцитов. Дыхание же на глутамате в
тимоцитах выше, чем в спленоцитах. Добавление АДФ к инкубированным в фосфатном
буфере спленоцитам, дышащим последовательно на глутамате и янтарной кислоте,
приводит к резкому подавлению поглощения кислорода, что объясняется, скорее
всего, изменением соотношения АТФ/АДФ в цитоплазме клетки. По-видимому,
увеличение АТФ в цитоплазме на фоне энергизации митохондрий приводит по принципу
отрицательной обратной связи к приостановке дыхания. В наших опытах дыхание
тимоцитов на глутамине ниже, чем на глутамате, что говорит о большей доступности
для митохондрий тимоцитов экзогенного глутамата, чем глутамата, образующегося из
глутамина через ФАГ.
Примечательно, что ГАМК,
который имеет свои рецепторы типа А на поверхности иммунных клеток [14],
подавляющие через CD3 их иммунную активность, понижает эндогенное дыхание
спленоцитов, не влияя существенно на таковое тимоцитов.
|
|
Рис.3. Дыхание спленоцитов на аминокислотных субстратах.
Концентрация субстратов: глутамин -
15 мМ, глутамат, ГАМК и кетоглутарат -
10 мМ, сукцинат - 6 мМ. Скорость эндогенного дыхания -
4.6
нМ.мин-1. мг-1 белка
Чанг и др. [15] считают, что стимуляция
пролиферации лимфоцитов глутамином связана с поддержанием соответствующего
внутриклеточного редокс-статуса. Kюри, Ньюшолм и др. отмечают высокую
глутаминазную активность лимфоцитов и нейтрофилов [8,10], однако, по их данным,
как и в наших опытах на тимоцитах и спленоцитах, дыхание на глутамине не
коррелирует с его превращением в глутамат. О низкой дыхательной активности
лейкоцитов на аминокислотных субстратах говорят также данные по выходу
14CO2 из меченого глутамина и достаточно высокий выход
аминокислот, которые, по-видимому, используются в синтезе белка. Но каким
образом обеспечивается энергетическая компонента этого синтеза, остается
неясным. Полученные нами данные не свидетельствуют в пользу использования
иммунными клетками глутамина в качестве эффективного дыхательного
субстрата.
Электрохимические исследования
проведены в рамках гранта NFSAT EISI 0101.
1Институт биохимии НАН РА
2Институт химической физики НАН
РА
1. Kvamme E. - Prog. Brain
Res. 1998. V. 1160. P. 73-85.
2. Roberg B.,
Torgner I. A., Kvamme E. - Neurochem. Int. 1995. V. 27. P.
367-376.
3. Rae C., Hare N., Bubb W. A. -
J. Neurochem. 2003. V.85. N 2. P. 503-510.
4. Reubi J. C., Van den Berg C. J., Cuenod M. - Neurosci. Lett. 1978. V. 10. P. 171-174.
5. Roberg B., Torgner I. A., Kvamme E. - Neurochem. Res.
1999. V. 24. N7. P. 809-814.
6. Yu A. C.
H., Fisher T. E., Hertz E., Schousboe A. - J. Neurosci. Res. 1984.
V. 11. P. 351-357.
7. Marcaggi P., Coles J.
A. - Progress Neurobiol. 2001. V. 64. P. 157-183.
8. Curi T. C., De Melo M. P., De Azevedo R.
B., Homem-de-Bittencourt P. I. - Am. J. Physiol. 1997. V. 273. P.
1124-1129.
9. Daikhin Y., Yudkoff M. -
J. Nutr. 2000. V. 130 (4S Suppl). P. 1026S-1031S.
10. Newsholme E. A. - Braz.
J. Med. Biol. Res. 1997. V. 30. N6. P. 345-361.
11. Палладин А. В., Кирсенко О. Б. - Биохимия. 1961. T. 26. C.
385-390.
12. Lowry O. H., Rosebrough N. T.,
Farr A. L. Randall R. J. - J. Biol. Chem. 1951. V. 193. P.
265-270.
13. Панавене Д. Г., Банджюлене С.
Ю. - Лабораторное дело. 1983. N4. С. 10-11.
14. Tian Chau C., Hales T. G., Kaufman D. L. - J.
Neuroimmunology. 1999. V. 96. P. 21-28.
15. Chang W. K., Yang K. D., Shaio M. F. - Clin Exp Immunol.
1999. V. 117. P. 482-488.