ОРГАНИЧЕСКАЯ ХИМИЯ
УДК 547.491.8.07 (0.88.8)
Академик В. В. Довлатян, К. А. Элиазян, В. А. Пивазян, А.
П. Енгоян
Реакция хлорида (2-метилмеркапто-6-метилпиримидинил-4)
триметиламмония с O-нуклеофилами
(Представлено 15/XII 2004)
В последние годы 2-меркаптоурацил и его
производные привлекли внимание исследователей в связи с их антитироидной
активностью [1]. Меркаптопиримидины обладают более кислыми свойствами по
сравнению с соответствующими оксисоединениями и при алкилировании первоначально
получаются алкилмеркаптопроизводные [2], однако не исключено также образование
O- или N-алкильных соединений.
Нами установлено, что 2-метилмеркаптоурацил
получается с хорошим выходом в воднощелочной среде при действии на
меркаптоурацил диметилсульфатом с соотношением реагирующих веществ 2:1:1.
Полученный 2-метилмеркаптопиримидин хлорирован оксихлоридом фосфора [3] и далее
переведен в хлорид (2-метилмеркапто-6-метил-пиримидинил-4) триметиламмония II
[4].
В настоящей работе приводятся данные о
широкой функционализации соли II.
Показано, что хлорид II в водной среде в
присутствии щелочи при низкой температуре гладко взаимодействует с
цианметилирующей смесью (CH2O + NaCN), этиленгликолем и
этиленхлоргидрином и образует, соответственно, 4-цианметилокси(III), 4-b-оксиэтилокси (VI) и 4-b-хлорэтилокси (VII) производные [5-7].
Соединение III под действием 10%-ной водной
щелочи, аналогично ранее полученным нами цианметилоксипроизводным [5], переходит
в кислоту IV, которая под действием диметилсульфата в диметилформамиде образует
эфир V. Последний в избытке 63%-ного гидразингидрата при 20oС
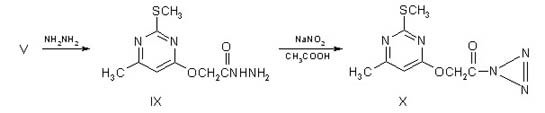
превращается в гидразид пиримидинил-4-оксиуксусной кислоты IX, а далее под
действием HNO2 - в азид X.
|

|
|
|
Было изучено поведение соединения VII в
условиях реакции перегруппировки, имеющей место в хлорэтокси-симм-триазинах [8].
Установлено, что соединение VII при нагревании в кипящем бензоле подвергается
перегруппировке с образованием N-b-хлорэтилпроизводного
VIII.
ИК спектры сняты на спектрофотометре UR-20 в
вазелиновом масле, а спектры ЯМР 1Н - на спектрометре Mercury-300 в
ДМСО-d6. ТСХ проведена на пластинах Silufol UV-254, в качестве
элюента применялась система ацетон-гексан (2:1), проявление 2%
AgNO3+2% БФС +4% лимонной кислоты.
2-Метилмеркаптоурацил. К
раствору 1.4 г (0.01 моля) 2-меркаптоурацила, 0.8 г (0.02 моля) едкого натра в
15 мл воды при охлаждении ледяной водой и перемешивании порциями добавляют 1.0
мл (0.01 моля) диметилсульфата. Смесь оставляют на ночь, затем подкисляют
10%-ной HCI. Фильтруют, получают 1.3 г (83%) 2-метилмеркаптоурацила, Т.пл.
213-215oС. Найдено, %: N 17.81; S 20.40. М+ 156.
C6H8N2OS. Вычислено, %: N 17.95; S 20.51.
2-Метилмеркапто-4-хлор-6-метилпиримидин (I). Суспензию 5.5 г
(0.035 моля) 2-метилмеркаптоурацила в 15 мл POCI3 кипятят 2 ч.
Отгоняют избыток POCI3, остаток переносят в стакан с колотым льдом,
нейтрализуют 25%-ным NH4OH и фильтруют. Получают 5.2 г (85%)
соединения I, Т.пл. 47-48oС (гексан), Rf 0.43. Найдено, %:
Cl 20.65; N 16.29. C6H7ClN2S. Вычислено, %: Cl
20.34; N 16.05.
Хлорид
[2-метилмеркапто-6-метилпиримидинил-4] триметиламмония (II). Получают
по ранее описанному способу [6]. Выход 86%, Т.пл. 136-137oС (разл).
Найдено, %: Cl 15.61; N 18.24. C9H16ClN3S.
Вычислено, %: Cl 15.20; N 17.99.
2-Метилмеркапто-4-цианметилокси-6-метилпиримидин (III). Получают
по описанию, приведенному в работе [5]. Выход 97%, Т.пл. 72-74oС
(эфир). Rf 0.39. Найдено, %: N 21.27; S 16.69.
C8H9N3OS. Вычислено, %: N 21.54; S 16.41. ИК
спектр, n, см-1:
2260 (C є N); 1585, 1560, 1505 (C = N, C = C); 1165-1120
(C - O - C). Спектр ЯМР
1Н, d, м.д.: 2.40 (3H, с, CH3);
2.56 (3H, с, SCH3); 5.15 (2H, с, CH2); 6.43 (1H, с, CH).
2-Метилмеркапто-6-метилпиримидинил-4-оксиуксусная кислота (IV).
Суспензию 2.0 г (0.01 моля) соединения III в 5 мл 10%-ного едкого натра
кипятят обратным холодильником 2-2.5 ч до прекращения выделения аммиака. Раствор
нейтрализуют HCI до pH6 и фильтруют. Получают 1.5 г (70%) кислоты IV. Т.пл.
170-172oС (50% C2H5OH). Rf 0.51.
Найдено, %: N 13.27; S 14.61.
C8H10N2O3S. Вычислено, %: N 13.08; S
14.95. ИК спектр, n, см-1: 1720 (C = O); 1570, 1600 (C = N, C = C); 1210, 1170
(C - O - C); 3300-3500 (OH).
Спектр ЯМР 1H, d, м.д.: 2.38 (3H, с,
CH3); 2.47 (3H, с, SCH3); 4.78 (2H, с, CH2);
6.39 (1H, с, CH); 12.0 (1H, о.ш.с. OH).
Метиловый эфир
2-метилмеркапто-6-метилпиримидинил-4- оксиуксусной кислоты (V). К
суспензии 0.7 г (0.01 моля) 84% едкого кали(порошок) в 10 мл ДМФА добавляют 2.2
г (0.01 моля) кислоты IV и перемешивают 2 ч для образования соли. Приливают 1.0
мл (0.01 моля) диметилсульфата и реакционную смесь нагревают при
50-60oС 2 ч. Фильтруют KCH3SO4, фильтрат
упаривают и обрабатывают водой. Фильтруют и получают 1.7 г (74%) эфира V. Т.пл.
58-60oС (гептан). Rf 0.45. Найдено, %: N 12.47; S 14.49.
C9H12N2O3S. Вычислено, %: N 12.28; S
14.04. ИК спектр, n, см-1: 1730 (C = O); 1560, 1530, 1500 (C = N, C = C); 1150
(C - O - C). Спектр ЯМР
1Н, d, м.д.: 2.38 (3H, c, CH3);
2.43 (3H, с, SCH3); 3.73 (3H, с, OCH3); 4.85 (2H, с,
CH2); 6.40 (1H, с, CH).
2-Метилмеркапто-6-метилпиримидинил-4-оксиэтанол (VI). Получают по
описанию, приведенному в работе [7]. Выход 90%, Т.пл. 65-66oС
(гексан). Rf 0.52. Найдено, %: N 14.37; S 16.43.
C8H12N2O2S. Вычислено, %: N 14.00; S
16.00. ИК спектр, n, см-1: 1610, 1580 (C = N, C = C); 1180, 1080 (C - O - C); 3200-3500 (OH). Спектр ЯМР
1Н, d, м.д.: 2.33 (3H, с, CH3);
2.50 (3H, с, SCH3); 3.62 (2H, т, J = 6.8 Гц, OCH2); 4.25
(2H, т, J = 6.8 Гц, ArOCH2); 6.12 (1H, с, CH).
2-Метилмеркапто-4-b-хлорэтилокси-6-метилпиримидин (VII). Получают по
описанию, приведенному в работе [6]. Выход 92%, Т.пл. 40-42oС (из
C6H6). Rf 0.38. Найдено, %: Cl 16.03; N 13.17;
S 15.00. C8H11ClN2OS. Вычислено, %: Cl 16.25; N
12.81; S 14.62. Спектр ЯМР 1Н, d, м.д.: 2.20
(3H, с, CH3); 2.60 (3H, с, SCH3); 3.82 (2H, т, J = 6.6 Гц,
CH2Cl); 4.45 (2H, т, J = 6.6 Гц, OCH2); 6.20 (1H, с, CH).
2-Метилмеркапто-N(3)-b-хлорэтил-6-метилпиримидинон-4 (VIII). Раствор 2.2 г
(0.01 моля) соединения VII в 10 мл абсолютного бензола кипятят обратным
холодильником 4 ч. Бензол отгоняют, остаток обрабатывают петролейным эфиром и
фильтруют. Получают 1.8 г (82%) соединения VIII. Т.пл. 80-82oС.
Rf 0.34. Найдено, %: Cl 15.97; N 13.11; S 14.25.
C8H11ClN2OS. Вычислено, %: Cl 16.25; N 12.81; S
14.62. ИК спектр, n, см-1: 1660 (C = O амид.); 1560, 1520, 1500 (C = N, C = C).
Спектр ЯМР 1Н, d, м.д.: 2.32 (3H, с,
CH3); 2.60 (3H, с, SCH3); 3.75 (2H, т, J = 6.5 Гц,
CH2Cl); 4.25 (2H, т, J = 6.5 Гц, NCH2); 5.96 (1H, с, CH).
Гидразид
2-метилмеркапто-6-метилпиримидинил-4-оксиуксусной кислоты (IX). Смесь 2.3
г (0.01 моля) соединения V и 9 мл 63%-нoго гидразингидрата перемешивают при
20oС в течение суток. Фильтруют, фильтр промывают водой и получают
2.0 г (87%) соединения IX. Т.пл. 152-154oС (разл.) (эфиром).
Rf 0.58. Найдено,%: N 25.00; S 14.36.
C8H12N4O2S. Вычислено, %: N 24.56; S
14.04. ИК спектр, n, см-1: 1680 (C = O); 1580, 1540 (C = N, C = C); 3350, 3320
(NHNH2).
Азид
2-метилмеркапто-6-метилпиримидинил-4-оксиуксусной кислоты (X). К
суспензии 2.3 г (0.01 моля) соединения IX в 30 мл воды прибавляют 1.8 г (0.025
моля) NaNO2 и затем при 0oС медленно порциями добавляют
1.5 г (0.025 моля) CH3COOH. Смесь перемешивают при 20-25oС
3 ч. Фильтруют, фильтр промывают водой и сушат на воздухе. Получают 2.2 г (90%)
соединения X. Т.пл. 50-52oС (разл.). Найдено, %: N 30.35; S 13.81.
C8H9N5O2S. Вычислено, %: N 29.29; S
13.39. ИК спектр, n, см-1: 1660 (C = O); 2140 (N = N+ = N). Спектр ЯМР
1Н, d, м.д.: 2.40 (3H, с, CH3);
2.48 (3H, с, SCH3); 4.95 (2H, с, OCH2); 6,42 (1H, с, CH).
Работа выполнена при финансовой поддержке
МНТЦ (проект А-370).
Армянская сельскохозяйственная академия
Литература
1. Salter - Ann. Rev. Biochem.
1945. V. 14. P. 570.
2. Lee J. - J. Am. Chem. Soc. 1938. V. 60. P. 993.
3. Henze H. R. - J. Org. Chem. 1952. V. 17. P. 1320.
4. Довлатян В. В., Элиазян К. А., Пивазян
В. А. - ХГС. 2001. №3, C. 349.
5. Довлатян В. В., Элиазян К. А. - Арм. хим. ж. 1971. T. 24.
№ . C. 354.
6. Довлатян В. В., Элиазян К.
А., Пивазян В. А., Казарян Э. А. - ХГС. 1996. №2. C.
237.
7. Довлатян В. В., Агаджанян Л. Г.,
Элиазян К. А. - Арм. хим. ж. 1974. T. 27. № . C. 238.
8. Довлатян В. В., - ХГС.
1996. №4. C. 435-448.
