|
|
УДК 576.858.25.098.396.332
Физико-химическая и биологическая характеристика РНК
вируса
венесуэльского энцефаломиелита лошадей
(Представлено академиком К.Г. Карагезяном 2/IX 2004)
Данные, накопленные в результате исследований
онтогенеза вирусов позвоночных, следовавших за изучением основных
закономерностей репродукции фагов, позволяют выделить ряд последовательных
этапов, из которых складывается взаимодействие вирусов с клетками. Процессы,
связанные с репродукцией вирусов, в основном состоят из трех периодов: начального (адсорбция и проникновение вируса в клетку
депротеинизация вирусной нуклеиновой кислоты), среднего (репликация вирусных нуклеиновых кислот, синтез структурных вирусных
белков) и конечного (формирование вирионов и освобождение
вируса). Синтез вирусных рибонуклеиновых кислот, как показано на модели ряда
вирусов, проходит через стадию синтеза репликативной формы РНК и одного из
возможных механизмов репликации - «консервативного» или «полуконсервативного»
[1,2].
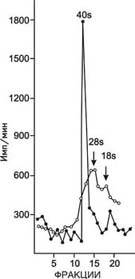
В наших исследованиях при изучении седиментационных и плотностных характеристик РНК вируса ВЭЛ установленно, что РНК, экстрагированная из очищенной вирусной суспензии после центрифугирования в 10/30% градиенте сахарозы и в градиенте плотности сернокислого цезия имеет коэффициент седиментации 38-40 S и распределяется в одной зоне с плавучей плотностью 1.66 г/см3, что отчетливо видно на рис. 1 и 2.
|
|
Для изучения электрофоретического профиля вирионной РНК и определения ее молекулярного веса соответствующие РНК-содержащие фракции сахарозного градиента объединяли, повторно экстрагировали фенолом и исследовали путем электрофореза в 3.5% полиакриламидном геле (рис. 3). На представленной электрофореграмме отчетливо видно, что вирионная 40 S РНК гомогенна и свободна от каких-либо примесей. Молекулярный вес вирионной РНК рассчитывали в сравнении с электрофоретической подвижностью маркерных 28 и 18 S 14С-уридин РНК. Подсчитанный таким образом молекулярный вес вирионной РНК вируса ВЭЛ оказался равным 4.3 × 106 дальтон. Надо сказать, что при расчете молекулярного веса РНК по формуле МВ = 1550 × S2.1, где S - коэффициент седиментации, получали значения, близкие к таковым, определенным при помощи электрофореза РНК в полиакриламидном геле. В то же время седиментационный анализ РНК, выделенной из клеток ФКЭ, инфицированных вирусом ВЭЛ, обработанных актиномицином Д и инкубированных с 3Н-уридином, показал, что вирус ВЭЛ индуцирует в клетках куриных эмбрионов синтез трех основных типов РНК с коэффициентами седиментации 40, 26, и 20-22 S. Первая из них РНК с коэффициентом седиментации 40 S аналогична вирионной РНК и чувствительна к действию РНК-азы, вторая, вновь синтезированная РНК с коэффициентом седиментации 26 S, также чувствительна к РНК-азе и большинством исследователей рассматривается в качестве репликативной промежуточной формы РНК, хотя ее функция до настоящего времени окончательно не выяснена. И наконец последний вид РНК, выявленной нами при седиментационном анализе вирусиндуцированной РНК-РНК с коэффициентом седиментации 20-22 S, - резистентная к действию РНК-азы и обозначенная как репликативная форма РНК (рис. 4). Фракционирование вирусиндуцированной РНК в градиенте плотности сернокислого цезия показало, что РНК распределяется в двух зонах с плавучей плотностью 1.66 и 1.60 г/см3.
|
|
Ранее было обнаружено, что
олигорибонуклеотиды и олигодезоксирибонуклеотиды усиливают иммунный ответ у
нормальных и облученных животных, активируют процессы пролиферации
антителообразующих и других клеток. Биологическая активность ДНК и РНК была
изучена при лечении таких заболеваний как центральная и периферическая
тапето-ретинальная дистрофия, незаживающие трофические язвы различной
локализации, при экспериментальном гепатите и аллоксановом диабете.
Положительный эффект нуклеиновых кислот отмечался также при их воздействии на
эспериментальные опухоли и др. [7-10]. Для выявления инфекционности РНК нами
модифицирован метод титрования инфекционности вирусов. Монослой культуры клеток
ФКЭ обрабатывали 1 М раствора NaCl в течение 15 мин при 18-20o С, в
состав агарового покрытия добавляли 2-3 мг/мл ДЭАЭ-декстрана, а адсорбция РНК на
клетках в отличие от вируса (30 мин) проходила в течение 3-5 мин при комнатной
температуре или при 37o С. Было установленно, что РНК, выделенная из
очищенного вируса ВЭЛ с титром инфекционности 1010 БОЕ/мл обладает
инфекционными свойствами, т.е способна при введении в организм лабороторных
животных или в монослой культуры клеток вызвать инфекционный процесс, причем
титры инфекционности РНК были в несколько раз ниже титров вируса -
103-104 БОЕ/мл. Описанный способ выявления титрования
инфекционности вирусной РНК был использован нами для определения инфекционных
свойств вирусспецифических РНК, выделенных из инфицированных вирусом ВЭЛ клеток,
и полученных в чистом виде после центрифугирования в градиенте плотности
сахарозы. После раскапывания фракций градиента было установленно, что
инфекционными свойствами обладают вирусспецифическая РНК с коэффициентом
седиментации 40 S (аналогичная вирионной РНК) и РНК с коэффициентом седиментации
20-22 S (репликативная форма РНК) (рис. 4). Ереванский государственный медицинский
колледж "Эребуни"
1. Агабалян А.С. - Биолог. ж. Армении. 1973. N6. С.
40-46
синтезированных de novo в клетках инфицированных вирусом
ВЭЛ: ·-·-·-
вирусспецифические РНК; ·-·-·- инфекционность; °-°-°- РНК,
обработанная РНК-азой.
препаратов вирусных РНК
Обработка
Титры инфекционности, в lg БОЕ/мл
РНК
Вирус
До обработки
После обработки
До обработки
После обработки
РНК-аза (5мкг/мл)
3.0
0
8.1
8.0
Трипсин (5мг/мл)
3.0
3.0
8.1
7.8
Иммунн. сыворотка
3.1
2.9
8.1
6.0
1 М NaCl
0
3.5
8.8
7.1
ДЭАЭ-декстран
0
3.5
8.8
9.0
Протамин-сульфат
0
3.3
8.6
8.7
2. Агол В.И. В кн.: Мол. биология вирусов. М. Наука. 1971. 395
с.
3. Анджапаридзе О.Г., Гаврилов
В.И., Семенов Б.Ф. и др. В кн.: Культура ткани в
вирусологических исследованиях. М. Медгиз. 1962. 235
с.
4. Мейхл Б. В кн.: Вирусология. Методы. М. Мир. 1988. 344
с.
5. Wecker E. - Virology. 1959. N7. P. 241-245.
6.
Остерман Л.Л. В кн.: Методы исследования
белков и нуклеиновых кислот. Электрофорез и ультрацентрифугирование. М. Наука.
1981. 285 с.
7. Агабалян А.С.
- Глобус науки. 2002. N2. С.
63-65.
8. Агабалян А.С.,
Карагезян К.Г. - ДНАН
Армении. 2002. N3. С. 258-261.
9.
Агабалян А.С., Макарян А.П., Давтян О.Я. и др. - ДНАН Армении. 2000. N2. С.
177-181.
10. Агабалян А.С.,
Туманян М.А., Захарян Р.А. и др. - ДНАН Армении. 1998. N4. С.
363-366.
11. Сhambers T., Hahn
C., Galler R. et. al. - Annu. Rev. Microbiol. 1990. V. 44.
P. 649-688.
12. Edward Z., Takegami T. - Microbiol. Immunol. 1993. V. 37. P.
239-243.
13. Egger D., Passamontes L., Bolten R. et. al - J. Virol. 1996. V. 70.
P. 8675-8683