БИОХИМИЯ
УДК 619: 616-006.446-097.2/:636.2
А. Ю. Ширванян, П. А. Казарян, Ю. А. Ширванян, академик А.
А. Галоян
Особенности изменений гематоморфологических показателей
крови коров, больных лейкозом, под действием пролин-богатого полипептида in
vitro
(Представлено 2/XI 2004)
Лейкоз крупного рогатого скота является,
главным образом, вирусным заболеванием, для которого характерно наличие высокого
уровня противовирусных антител и интегрированного ДНК - провируса, находящегося
в лимфоцитах в репрессированном состоянии. Лейкоз развивается не у всех
инфицированных животных. Для развития болезни, кроме наличия вируса, необходимы
также другие факторы, определяющие резистентность организма [1-3].
В последнее время особое внимание уделяется
выяснению взаимосвязи развития лейкозов с иммунной недостаточностью организма.
Установлено иммунодепрессивное воздействие вируса лейкоза (ВЛ) крупного рогатого
скота, выражающееся в резком подавлении функциональной активности лимфоцитов
[4,5]. Нарастание количества лейкоцитов в крови имеет место только на фоне
индуцированной таким вирусом иммунодепрессии, при которой наблюдается подавление
иммунореактивности, предшествующее развитию синдрома лимфоцитоза [6].
Положительное воздействие на организм больных
лейкозом животных могут оказать пролин-богатые полипептиды (ПБП), представляющие
собой новую семью иммуномодуляторов, продуцируемых магноцеллюлярными клетками
NPV и NSO гипоталамуса животных [7-10].
Опухоли органов иммунной системы
классифицируются как лимфомы и лейкемии [11]. А.А. Галоян и В.А. Шахламов
показали, что ПБП-1 оказывает прямое подавляющее влияние на пролиферацию
опухолевых Т-клеток человека, на так называемые Jurkat клеток. ПБП-1 in vitro
дозозависимым образом (1×10-10-1×10-6 М) ингибирует
пролиферацию этих клеток. Выяснилось также, что ПБП-1 в условиях in vitro
разрушает ультраструктуру опухолевых клеток фибробластов (L929)[12],
а также клеток нейриномы Гассерова узла у крыс [13]. В настоящем исследовании
приводятся данные о прямом воздействии (in vitro) ПБП-1 на клетки крови.
В опытах использовали пробы цельной крови 12
коров, принадлежащих жителям села Айанист Масисского района (пробы крови брались
из яремной вены животного).
При определении содержания гемоглобина,
количества эритроцитов и лейкоцитов в 1 мкл крови, приготовлении и фиксации
мазков крови, окраске их по Романовскому-Гимза использовались общепринятые
методы ветеринарной гематологии. Подсчет лейкоцитарной формулы крови,
дифференциация отдельных форм лейкоцитов проводились на окрашенных препаратах
под иммерсионным объективом при увеличении в 630х, а структуры клеточных
элементов - при увеличении в 900х. Для исследования сывороток крови с целью
выявления инфицированных ВЛ животных методом реакции иммунодиффузии использовали
коммерческий набор Курской биофабрики. ПБП-1 в виде водного раствора добавлялся
в пробирки из расчета 0.01 мкг на 1 мл крови (0.1 мкг в 10 мкл инкубационной
смеси, инкубационный период 24 ч при температуре 37,5o).
Результаты исследований показали, что из 12
проб крови 8 реагировали положительно по реакции иммунодиффузии. По данным
гематологических и цитоморфологических исследований проб крови животные были
разделены на три группы (по 4 головы в каждой): здоровые, в предлейкозном
состоянии, в начальной стадии развития лейкозного процесса.
Выяснилось, что под действием препарата in
vitro в крови у здоровых коров существенных сдвигов в уровне изучаемых
показателей не наблюдалось.
У животных, находившихся в предлейкозном
состоянии, количество лейкоцитов и абсолютное количество лимфоцитов в 1 мкл
крови снизилось на 30 и 35%, соответственно (p < 0.01), а относительное
содержание лимфоцитов в лейкоформуле - на 9%. Значительные изменения наблюдались
в относительном содержании отдельных субпопуляций лимфоцитов. При этом
отмечалось резкое повышение количества малых лимфоцитов (до 67%) (p < 0.001)
на фоне понижения количества средних лимфоцитов (p < 0.001). Примечательно,
что до применения препарата относительный уровень больших лимфоцитов в крови у
этой группы коров составлял 11.5±0.6% (от общей суммы
лимфоцитов), тогда как после воздействия ПБП-1 обнаружить клетки этой
субпопуляции лимфоцитов не удалось.
Выраженные изменения указанных показателей
под воздействием ПБП-1 наблюдались в крови коров, находившихся в начальной
стадии развития лейкозного процесса. Количество лейкоцитов и абсолютное
количество лимфоцитов снизилось на 30 и 41%, соответственно (p < 0.001), а
относительное содержание лимфоцитов в лейкоформуле - на 11% (p < 0.01).
Существенные сдвиги наблюдались в относительном содержании отдельных
субпопуляций лимфоцитов. Уровень малых лимфоцитов повысился более чем в два раза
(p < 0.001) на фоне статистически достоверного (p < 0.001) снижения
содержания средних лимфоцитов. Клеток субпопуляции больших лимфоцитов после
применения ПБП-1 обнаружить не удалось, тогда как до применения ПБП-1 содержание
больших лимфоцитов составляло 20.2±0.3% (от общей суммы
лимфоцитов).
Известно, что изменение количества лейкоцитов
и содержания лимфоцитов, а также отдельных субпопуляций лимфоцитов обусловлено
увеличением относительного содержания трансформированных В-лимфоцитов,
циркулирующих в периферической крови, которые характеризуются патологически
измененными метаболизмом и функционально-структурными особенностями. В основе
изменений относительных содержаний этих показателей при развитии лейкоза лежат
понижение более реактивных и резистенных малых лимфоцитов и повышение менее
устойчивых средних и больших лимфоцитов.
|
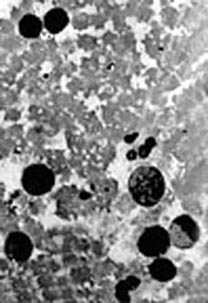
|
Рис.1. Картина периферической крови у здоровых коров.
По нашим данным под воздействием ПБП-1 in
vitro отмечается определенная тенденция к нормализации рассматриваемых
показателей. При этом подавляющее воздействие ПБП-1 на пролиферацию
злокачественно трансформированных клеток выражено снижением числа тех
лимфоцитов, повышение которых способствует дальнейшему прогрессированию
лейкозного процесса. Если предлейкозное состояние болезни характеризуется
усиленной пролиферацией лимфоидных клеток, которая проявляется в крови только
лимфоцитозом (повышением числа нормальных лимфоцитов), то в начальной стадии
обнаруживаются также малодифференцированные и атипичные опухолевые клетки, как в
периферической крови, так и в кроветворных органах. По данным наших исследований
относительное содержание таких клеток составляло 1.7%.
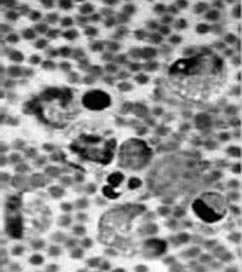
Рис.2. Картина периферической крови у коров в начальной
стадии развития лейкоза.
При цитоморфологических исследованиях мазков
периферической крови животных до применения гипоталамического цитокина ПБП-1 в
морфологической структуре нейтрофилов (палочко- и сегментоядерных), эозинофилов
и моноцитов выраженных изменений не наблюдалось (рис.1). В мазках крови коров
только в начальной стадии развития лейкоза были обнаружены единичные
пролимфоциты, лимфобласты и атипичные опухолевые клетки (рис.2). Под
воздействием препарата выраженные цитоморфологические изменения обнаружены в
различных субпопуляциях лимфоцитов. В поле зрения в большом количестве выявлены
остатки разрушенных, в основном больших и средних, лимфоцитов, при этом в
структуре малых лимфоцитов изменений не наблюдалось. После применения ПБП-1 в
мазках крови коров в начальной стадии болезни не обнаружены пролимфоциты,
лимфобласты и атипичные опухолевые клетки. Нам удалось выявить не только
клеточные остатки распада трансформированных лимфоцитов, но и сам процесс
разрушения, при котором целостность клетки сохранена, но хроматин ядра полностью
разрушен (рис.3).
Под воздействием препарата в морфологической
структуре нейтрофилов и эозинофилов существенных изменений не наблюдалось (ядра
единичных эозинофилов были растянуты).
Рис.3. Картина периферической крови у коров в начальной
стадии лейкоза под
воздействием ПБП-1.
Таким образом, сравнительная оценка
количественных и качественных изменений гематологических и цитоморфологических
показателей крови при лейкозе крупного рогатого скота под воздействием
гипоталамического цитокина ПБП-1 в условиях in vitro свидетельствует о прямом
влиянии препарата на состояние клеток крови. Это подтверждается дегенеративными
структурными расстройствами числа как менее реактивных средних и больших
лимфоцитов, так и малодифференцированных и атипичных опухолевых клеток. Можно
полагать, что действие ПБП-1 будет более эффективным при введении этого
нейрогормона in vivo, где подключаются защитные механизмы всей иммунной системы
организма.
Институт биохимии им. Г.Х.Бунятяна НАН
РА
Научный центр животноводства и ветеринарии
РА
Гематологический центр им. проф.
Р.Л.Еоляна МЗ РА
Литература
1. Rooney C.M., Smith C.A.,
Heslop H.E. - Today. 1997. V. 3. P.
24-30.
2. Papadoponlos E.B.,
Ladanyi M., Emanuel D. et al. - New England Journal of
Medicine. 1994. V. 330. P. 1185-91.
3. Бурба Л.Г., Кунаков А.А. В кн.: Диагностика
лейкозов сельскохозяйственных животных. М. Колос.
1983.
4. Гевондян В.С., Коропов
И.В., Ростгауз Р.Л. - Бюллетень ВИЭВ. 1988. Вып. 67. С.
16-21.
5. Гевондян В.С., Коропов
И.В. - Бюллетень ВИЭВ. 1988. Вып. 67. С. 21-24.
6. Шишков В.П., Бурба Л.Г.
- Лейкозы сельскохозяйственных животных. М. Агропромиздат.
1988.
7. Galoyan A.A. Nauka. Publischers. M. 1997. 240 p.
8.
Galoyan A.A. K luwer Academie/Plenum
Publishers. 2004. 188 p.
9. Aprikyan V.S., Galoyan A.A. Encyclopedia Armenica
publishing House. Yerevan. 2001. P. 22-34.
10.
Galoyan A.A., Aprikyan V.S.. Neurochemical
Research. 2002. V. 27. N 4.
P. 303-313.
11. Goldsby
R.A., Kindt Th.S., Osborne B.A.. KUBY Immunology. W.H.
Freeman and Company. New York. 2000. P.
544.
12. Галоян А.А.. Шахламов
В.А., Малайцев В.В. Медицинская наука Армении. 2001. T. 41.
N 1. С. 25-29.
13. Галоян А.А.,
Шахламов В.А., Кондакова Л.И., Алтухова В.И., Полякова Г.П. ДНАН Армения. 2001. Т. 101. N 2. С. 279-286.