АНАЛИТИЧЕСКАЯ ХИМИЯ
УДК 542.61+535.2+549.27+668.813
Н. О. Геокчян, Дж. А. Микаелян, М. Ж. Гегчян, А. Г.
Хачатрян
Взаимодействие хлоридного комплекса родия (III) с основным
красителем
оксинового ряда пиронином "Б" экстракционно-абсорбциометрическим
методом в солянокислой среде
(Представлено академиком К.А. Костаняном 10/VI 2004)
Для определения микрограммовых количеств
различных элементов платиновых и благородных металлов применяются
экстракционно-абсорбциометрические и экстракционно-флуориметрические методы с
использованием основных красителей [1-3]. Эти методы с использованием основного
красителя пиронина "Б" дают возможность определить микрограммовые количества
некоторых представителей металлов платиновой и благородной группы [4-6]. Однако
данные относительно экстракционно-абсорбциометрического определения
микроколичеств родия с помощью основных красителей в литературе отсутствуют. С
другой стороны, из литературных данных известно, что в аналитической химии
обычно имеют дело с комплексными хлоридами родия (III). Чтобы рассматривать
пиронин "Б" как новый краситель, необходимо дополнить исследования по
определению других металлов, в частности, данные относительно
экстракционно-абсорбциометрического определения микроколичеств родия.
В настоящей работе показана возможность
применения основного красителя оксинового ряда пиронина "Б" (ПБ) для
экстракционно-абсорбциометрического определения родия (III) в солянокислой
среде.
Из литературных данных известно, что
комплексная кислота гексахлорродиата (H3RhCl6) образует
соединения и с органическими основаниями [7]. Стандартный запасной раствор
гексахлорродиата (III) готовили растворением RhCl3 · 4H2O в
6М HCl, нагревая раствор около часа до 110oС. При этом получается 95%
раствор гексахлорродиевой кислоты. Разбавляя исходный раствор, получаем рабочие
растворы родия (III) необходимой концентрации. Водный раствор красителя пиронина
"Б" готовили растворением точной навески препарата марки "ч.д.а." в
дистиллированной воде. Использовались органические растворители квалификации
"ч.д.а." "х.ч." (дихлорэтан квалификации "ч." без дополнительной очистки).
Равновесные значения pH водной фазы
контролировали при помощи pH-метра pH-121 со стеклянным электродом. Оптическую
плотность (ОП) водных растворов и органических экстрактов измеряли на
спектрофотометре СФ-16. Из большого числа органических растворителей, а также их
бинарных смесей, опробованных для извлечения образующегося тройного соединения,
наиболее эффективной оказалась бинарная смесь дихлорэтана (ДХЭ) с
четыреххлористым углеродом (CCl4) в объемном соотношении 1.5:1 (6 и 4
мл соответственно), обеспечивающая минимальные фоновые значения ОП (ОП"хол" = 0.018). Объемное соотношение водной и органической
фаз 2:1 (10 и 5 мл соответственно).
После экстракции наблюдается осаждение
ионного ассоциата (ИА) между водной и органической фазами. Это явление совпадает
с теорией Кузнецова, согласно которой ИА образуются между двумя фазами в твердом
состоянии. После разделения фаз полученный осадок флотируется на стенках и дне
делительной воронки. Осадок ИА хорошо растворяется в ацетоне. Оптимальное
количество ацетона, обеспечивающее максимальные значения ОП экстрактов ИА при
минимальной ОП "холостых" экстрактов, составляет 3 мл. Таким образом, в качестве
экстрагента далее применяли тринарную смесь ДХЭ + CCl4 + ацетон (6, 4 и 3 мл соответственно).
Были сняты спектры поглощения органических
экстрактов образующегося ИА "холостого" опыта и водного раствора.
Во всех случаях максимум светопоглощения
наблюдается при одной и той же длине волны l = 545 нм.
Для определения оптимальных условий экстракции была изучена зависимость ОП
экстрактов ИА от кислотности водной фазы в интервале от pH 4.0 до 3.0 моль/л по
соляной кислоте. Было установлено, что максимальные и постоянные значения ОП
экстрактов ИА с ПБ наблюдаются при pH 2.0 по соляной кислоте. Максимальное и
постоянное значение ОП ИА получается при концентрации 1.0 мл 0.05% раствора ПБ.
Образующийся ИА практически количественно извлекается в органическую фазу
однократной экстракцией. Экстракционное равновесие создается в течение 1 мин.
Фактор извлечения R = 0.92. ОП экстрактов ИА гексахлорродиата с ПБ сохраняется в
течение 1 ч. Диапазон определяемых содержаний родия (III) с ПБ составляет
0.73-14.63 мкг/10 мл. На основании данных калибровочного графика рассчитан
средний молярный коэффициент погашения
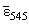 = 6.3 · 104 л · моль-1 · см-1. Предел
обнаружения, рассчитанный по 3S-критерию, Cmin = 0.03 мкг/мл. Для
определения стехиометрического соотношения реагирующих компонентов были
использованы данные, полученные из кривой насыщения реагента (метод Асмуса) [8].
С ПБ функция прямолинейна при n = 1. Следовательно, мольное отношение компонентов
в образующемся ионном ассоциате тетрахлорродиата к катиону ПБ равно 1:1.
Полученные нами экспериментальные данные полностью согласуются с литературными.
= 6.3 · 104 л · моль-1 · см-1. Предел
обнаружения, рассчитанный по 3S-критерию, Cmin = 0.03 мкг/мл. Для
определения стехиометрического соотношения реагирующих компонентов были
использованы данные, полученные из кривой насыщения реагента (метод Асмуса) [8].
С ПБ функция прямолинейна при n = 1. Следовательно, мольное отношение компонентов
в образующемся ионном ассоциате тетрахлорродиата к катиону ПБ равно 1:1.
Полученные нами экспериментальные данные полностью согласуются с литературными.
В водных растворах хлоридных комплексов родия
(III) в зависимости от концентрационных и других условий в результате процессов
акватации, гидролиза и анионирования образуются различные по составу
аквохлоридные и гидроксоаквохлоридные комплексы. Комплексный анион
[RhCl6]3- подвергается акватации
при концентрации хлорид-иона меньшей 6М [9-11].
Изучена кинетика акватации комплексов
[RhCl6]3- и
[RhH2OCl5]2- при m = 4.0 м [H+] [ClO4-, Cl-]
[12].
Кинетические уравнения процессов
Хлораквокомплексы родия (III) обладают
кислотными свойствами [13]. Следовательно, в установленных оптимальных условиях
растворов существует [Rh(H2O)2Cl4]- форма, которая в водной фазе как слабая кислота
взаимодействует с катионом основного красителя оксинового ряда ПБ, имеющим +1
заряд, образуя ионный ассоциат. Реакция взаимодействия идет по уравнению
| H[Rh(H2O)2Cl4] + RCl =
R[Rh(H2O)2Cl4] +
HCl, | |
где RCl - молекула
пиронина "Б".
Поэтому мольное отношение компонентов в
образующемся ионном ассоциате тетрахлорродиата (III) к катиону ПБ равно 1:1,
т.е.
| [Rh(H2O)2Cl4]- : [ПБ]+=1:1. | |
В установленных оптимальных условиях было
изучено влияние посторонних и сопутствующих элементов на избирательность
экстракции ИА родия (III) с ПБ. При определении концентрации родия 14.6 мкг/10
мл не мешают 104-кратные количества Al (III), 103-кратные
количества Co (II), Mg (II), Ni (II), Cu (II) и Cd (II), а
из анионов CrO42- и
102-кратные количества Zn (II). Определению мешают Pt (IV), Os (IV) и
Fe (III).
Математическая обработка результатов
приведена в таблице (n = 5, P = 0.95, ta=2.78, l = 545
нм).
Проведенная работа показывает, что
пиронин "Б" можно рассматривать как новый основной краситель при
экстракционно-абсорбциометрическом определении микрограммовых количеств
платиновых и благородных металлов.
Авторы выражают благодарность А.А. Егиазаряну
за участие и помощь в работе.
Ереванский государственный университет
Литература
1. Геокчян Н.О., Егиазарян
А.А., Микаелян Дж.А., Хачатрян А.Г. - Диагностика
материалов. 1998. Т. 64. N 11.
С. 15-17.
2. Микаелян
Дж.А., Арцруни В.Ж., Геокчян Н.О., Хачатрян А.Г. - ДНАН
Армении. 1998, Т. 98. N 2.
С. 158-160.
3. Геокчян
Н.О., Егиазарян А.А., Микаелян Дж.А., Хачатрян А.Г. - ДНАН
Армении. 1999. Т. 99. N 2.
С. 189-193.
4. Геокчян
Н.О., Хачатрян А.Г. - Арм. хим. ж. 1990. Т. 43. N 9.
С. 572-576.
5. Геокчян
Н.О., Хачатрян А.Г. - Ученые записки ЕГУ. 1992. N 1.
С. 129-132.
6. Геокчян
Н.О., Хачатрян А.Г. - Хим. жур. Армении. 1996. Т. 49.
N 1-3. С. 111- 112.
7. Гинзбург С.И., Езерская Н.А., Прокофьева И.В., Федоренко
И.В., Шленская В.И., Бельский Н.К. Аналитическая химия платиновых
металлов. М. Наука. 1972. С. 58.
8. Булатов М.И., Калинкин И.П. Практическое руководство
по фотометрическим и спектрофотометрическим методам анализа. Изд. 2. Л. Химия.
1968. С. 187.
9. McNevin W., McKay W. - Anal. Chem. 1957. V. 29.
P. 12-20.
10. Preetz
W., Blasius E.Z. - Anorg. Algem. Chem. 1964. V. 332.
P. 140.
11. Van Loon J.
- J. Page Canad. J. Chem. 1961. V. 44.
P. 515.
12. Robb W.,
Steyn V. - Inorg. Chem. 1967. V. 6.
P. 616.
13. Беляев
А.В., Птицын Б.В. - Ж. неорг. химии. 1966. Т. 11.
С. 417, 717, 766.
![]() ± ta · S /
± ta · S /![]()
![]() · 100%
· 100%![]()