УДК 577.15
Влияние галармина и его производных на активность
гликогенфосфорилазы a в некоторых тканях белых крыс
(Представлено 29/ХII 2003)
Биологически активные пептиды, выделенные из
секреторных гранул нейрогипофиза, образуются из высокомолекулярных
белков-предшественников, подвергающихся ряду посттрансляционных модификаций
(глюкозилированию, фосфорилированию и т.п.). Aкадемиком А. А. Галояном показано,
что эти пептидные фракции на препаратах in vivo и in vitro обладают мощным
иммуностимулирующим эффектом [1,2].
В
организме иммунная и нервная системы взаимодействуют друг с другом. В здоровом
организме имеет место модулирование иммунной реактивности нервами,
иннервирующими лимфоидные органы; с другой стороны, медиаторы иммунной системы
оказывают влияние на функции мозга. Примером могут служить инфекционные болезни
и травматические повреждения ЦНС, аутоиммунные и нейродегенеративные болезни, в
частности, болезни Альцгеймера и Паркинсона. Установлено, что в патогенезе
вышеуказанных болезней важную роль играют ферменты углеводно-фосфорного обмена,
когда нарушаются процессы фосфорилирования-дефосфорилирования белков
[3-5].
В настоящее время известно уже целое
семейство гипофизарных и гипоталамических гормонов, вовлеченных в регуляцию
обмена фосфопротеинов разными механизмами действия [6,7], некоторые из них тесно
связаны с каскадом реакций, запускаемых сАМР [8-10]. Регулируя гликолитические
процессы фосфорилазы, эти нейропептиды играют ключевую роль в процессе
метаболизма углеводов, переводя их из запасной формы в метаболитически активную.
Превращение крахмала и других сходных с ним
глюкозосодержащих полисахаридов (гликогена) также катализируется фосфорилазами.
Реакция представляет собой фосфоролиз с отщеплением глюкозы и образованием
глюкозо-1-фосфата. Будучи первым звеном в катаболической цепи реакций
фосфорилаза является объектом воздействия разнообразных регуляторных
механизмов.
Задачей настоящего исследования
было выявить биологический спектр действия пролин-богатых пептидов мозга (пептид
с 15 аминокислотными остатками - пролин-богатый пептид-1 (ПБП-1 или галармин),
пептид с 14 аминокислотными остатками -N 174 и пептид с
10 аминокислотными остатками с С-концевым свободным пролином -N 173) на активность гликогенфосфорилазы (ГФ) - одного из
ключевых ферментов в регуляции гликогенолиза в животных тканях. Учитывая, что
активность гликогенфосфорилазы непосредственно связана со статусом ее
фосфорилированности, в опытах in vitro определялась активная ГФ (ГФ-а), как на
уровне гомогената, так и на чистом ферменте.
Опыты проводились на тканях белых крыс линии Висмар массой 100-120 г, а
также на чистом ферменте, выделенном из мышц кролика, из расчета 1 мг
фосфорилазы а в 1 мл дистиллированной воды.
Животных декапитировали, ткани быстро промывали дистиллированной водой
на холоду и гомогенизировали в стеклянном гомогенизаторе в пятикратном объеме
ТЭМ-буфера (0.04 М трис - 0.002 М ЭДТА - 0.01 М меркаптоэтанол), рН 6.8.
Активность фосфорилазы в обоих случаях (КФ 2.4.1.1) определяли по Иллингворту и
Кори [11]. Исследуемый материал предынкубировали 2 мин при 30o C 0.1
мл 4% водного раствора гликогена, 0.1 мл ТЭМ-буфера, 0.1 мл исследуемого пептида
и далее для хода реакции добавляли 0.1 мл 64 мМ глюкозо-1-фосфата. Через 5 мин
реакцию останавливали 1.6 мл охлажденной 5% ТХУ. Активность фермента определяли
по убыли неорганического фосфора в реакционной смеси по методу Таусски и Шора
[12].
Aмилолитическая и фосфоролитическая
активность тканей отдельных органов животных неодинакова. Гликогенфосфорилазы из
разных источников отличаются не только по уровню активности, но и по
чувствительности к разным эффекторам, что, по-видимому, связано с особенностями
четвертичной структуры фермента, определяющей его тканевую гетерогенность [13].
Поскольку имеющиеся литературные сведения не содержат информации о возможном
влиянии пептидов, выделенных из нейросекреторных гранул нейрогипофиза крупного
рогатого скота, на гликогенфосфорилазную активность, нами было изучено
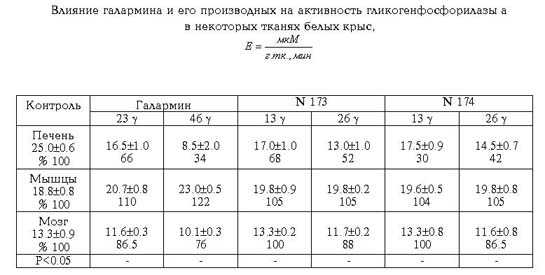
воздействие галармина и его производных, взятых в физиологических (и
субфизиологических) концентрациях, на активность фермента печени, мышц и мозга
белых крыс и очищенном ферменте (таблица). Активность ГФ-а под действием этих
биологически активных веществ менялaсь по-разному.
|
|
Опыты с добавлением галармина, N 173, N 174 на печеночную ткань показали
существенное подавление (66-58%) активности фермента в концентрации 46 g. Ингибирующий эффект этих пептидов значительно ослабевал
при концентрации 26 и 13 g (соответственно 47 и 30%).
Понижение активности ГФ-а говорит о переключении метаболических механизмов на
преимущественное депонирование гликогена. Особая роль печени в обмене гликогена
обуславливает наличие определенной специфики регуляторных свойств
гликогендефосфорилазы в этом органе. Общеизвестно, что ГФ, являясь
фосфопротеином, находится под контролем соответствующих протеинкиназ и
фосфопротеинфосфатаз, осуществляющих фосфорилирование и дефосфорилировaние. Не
исключено, что в этом случае сдвиги в активности фермента происходят вследствие
нарушения деятельности вышеуказанных ферментов.
Изменения в активности мозговой фосфорилазы a под действием пептидов
менее выражены и характеризуются разнотипностью в картине регулирования. Если
ударные дозы пептида 46 g ингибируют активность
фермента на 13% и 24%, то при концентрации 23 g
активирование ГФ-а невелико (10-6%). В то же время абсолютная величина
активности фермента под действием низких концентраций (13 g) практически не отличается от контрольных величин.
По-видимому, в данной ткани эти пептиды осуществляют не только регулирующую, но
и протекторную функцию.
Аналогичные
исследования по выявлению действия указанных пептидов на ГФ-а были проведены на
мышечной ткани белых крыс. Получена следующая картина: галармин и его
производные в количестве 46 и 26 g в известной мере
активировали фермент мышц, слабый активирующий эффект прослеживался в отношении
ГФ-а при добавлении пептидов в кoличестве 13 и 26 g.
Как видим, здесь наблюдается корреляция между активностью фермента и
концентрацией пептида. По-видимому, такое активирование фермента связано с
изменением статуса его фосфорилированности, т.е. переходом неактивной ГФ в ГФ-а.
Накопление ГФ-а должно способствовать усилению деградации гликогена в мышцах
животных.
Для полной характеристики
воздействия исследуемых полипептидов на фосфорилазную активность наряду с
мышечными тканями крыс нами был использован также коммерческий фермент
фосфорилазы а, выделенный из мышц кролика (рисунок). Учитывая описанный выше
эффект активации, можно было предположить, что подобный эффект мог быть получен
и на очищенном ферменте. Однако, как показали экспериментальные данные, галармин
и его производные в большинстве случаев выступают ингибиторами этого фермента. В
частности, как видно из кривой на рисунке, высокие концентрации подавляют
активность вдвое, низкие - на 20-30%, а концентрации 1.5, 0.55 и 0.001 g фактически не действуют на уровень ферментативной
активности. Такое расхождение в полученных результатах относительно тканевого и
чистого фермента можно объяснить в одном случае прямым влиянием галармина на
фермент, в другом, на уровне гомогената, - возможным участием каскадной системы
сАМР.
|
|
Действие галармина на активность очищенной фосфорилазы а.
По оси абсцисс: К - контроль, Экспериментальные данные по действию пептидов
на ГФ-a разнородны и с трудом поддаются систематике и обобщению. Весьма
вероятно, что в клетке ГФ ее киназа и фосфатаза образуют ансамбль функционально
связанных белков, гибко реагирующих на изменения внутренней среды.
Институт биохимии им. Г. Х. Бунятяна НАН
РА
галармин в g. По оси
ординат: активность фосфорилазы а в E ([(мк моль
Р)/(мг белок/мин)]);
Количество опытов -
8.
Большинство приведенных нами данных
свидетельствуeт о том, что исследуемые пептиды могут служить эффективными
регуляторами ГФ, входящей как одно из ведущих звеньев в сложную каскадную
системy углеводно-фосфорного обмена.
1. Галоян А. А., Шахламов В.
А., Богданова И. М., Малайцев В. В., Михалева Л. М. - Нейрохимия.
2002. T. 19. N1. C. 41.
2. Галоян А. А. - Нейрохимия. 2001. T. 18. N2. C. 83.
3. Arias C., Arrieta Y., Tapra
R. - J. Neurochem. 1997. V. 69. Sungl. P. 48.
4. Mumley G., Sonjag E.,
Nunbhaki-Craig V., Lee G., Blooms G. - J. Neurochem. 1997. V. 69.
P. 165.
5. Северин Е. С.,
Кочеткова М. Н. Роль фосфорилирования в регуляции клеточной
активности. М. Наука. 1985. 286 с.
6. Kevorkian G. A., Kanayan A. S. et al. - Proceedings of the
International Conference. Sept. 15-19. 2001. Yerevan-Tsakhadzor.
7. Reil F. J., Levin M. J. M.
- Proc. Nat. Acad. Sci. USA. Biol. Sci. 1982. V. 79. P. 978.
8. Exton J. H., Cerington A.
D. et al. In: Protein Phosphorilation, Book A. (ed. Rosen M.,
Krebs E.). Cold Spring Horbor Laboratory. 1981. P. 513-528.
9. Галоян А. А., Абелян Ж. Г.,
Баев В. В., Тер-Татевосян Л. П., Парсаданян Г. К. - Вопр. мед.
химии. 1979. Т. 25. N 3. С. 285-288.
10. Sim A. T., R. Collins E., Mudge L. M. - J.
Neurochem. 1997. V. 69. P. 163.
11. Illingwort B. I., Cori C. T. - Biochem. Preparations.
1953. V. 3. P. 1-9.
12. Taussky H. H., Shorr E. - J. Biol. Chem. 1953. V. 202. P.
675-685.
13. Dombradi V. -
Int. J. Biochem. 1981. V. 13. P. 125-139.