УДК 547. 855
Двукратная рециклизационная перегруппировка производного
пиразоло[1,5-a]пиримидина
(Представлено академиком В. В. Довлатяном 15/X 2004)
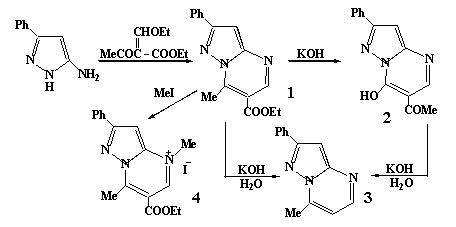
4-Метил- и 4-амино-5-этоксикарбонилпиримидины
перегруппировываются, соответственно, в 4-окси-5-ацетил- и
4-окси-5-карбамоилпиримидины [1]. В настоящей работе мы исследовали превращения
конденсированной системы -
2-фенил-6-этоксикарбонил-7-метилпиразоло-[1,5-a]пиримидина (1) под действием щелочи.
Конденсацией 3-амино-5-фенилпиразола с этиловым эфиром
этоксиметиленацетоуксусной кислоты получен пиразолопиримидин 1, который в спиртовом растворе КОН при комнатной температуре
легко перегруппировывается в 2-фенил-6-ацетил-7-оксипиразоло[1,5-a]пиримидин (2). В более жестких условиях - при длительном кипячении
соединений 1 и 2 в 15% водно-спиртовом
растворе едкого кали, вместо ожидаемых производных пиразоло[3,4-b]пиридина
(продуктов перегруппировки Коста-Сагитуллина [2]), нами выделен
2-фенил-7-метилпиразоло[1,5-a]пиримидин (3).
С целью выяснения расположения метильной
группы в соединениях 1 и 3 (5 либо 7)
был синтезирован йодметилат пиразолопиримидина 1, которому
на основании спектров ЯМР, снятых по методике NOESY, приписано строение
соединения 4. В спектре отмечено дальнее взаимодействие
протонов N-метильной группы как с протоном 3-Н пиразольного кольца (что
однозначно говорит об алкилировании по атому N-4), так и с протоном 5-Н.
Последнее, наряду с тем, что в спектре нет сигнала, свидетельствующего о
взаимодействии протонов двух метильных групп (3.21 и 4.46 м.д.), доказывает факт
нахождения метильной группы кольца в отдаленном от кватернизованного атома азота
- 7-ом положении как в самом йодметилате 4, так и в
пиразолопиримидинах 1 и 3.
|
|
Отмеченная трансформация соединений 1 и 2 в соединение 3 является неординарной перегруппировкой, идущей через последовательную цепь процессов раскрытия и замыкания пиримидинового цикла (схема приведена ниже).
|
|
Спектры ЯМР были получены в Центре
исследования строения молекул НАН РА (программа US CRDF RESC 17-5), на приборе
Varian "Mercury 300" с резонансной частотой 300.077 MГц на ядре атома водорода и
75.46 MГц на ядре 13C. Температура образцов 303K. Масс-спектры
зарегистрированы на спектрометре МК-1321 с прямым введением образца в ионный
источник и при энергии ионизации 70 eV. Для хроматографии в тонком слое
использовали пластинки Silufol UV-254, проявляли парами йода и реактивом Эрлиха.
Институт органичeской химии НАН РА Литература 1. Данагулян Г. Г., Мкртчян А.
Д. - ХГС. 2003. N 11. C. 1735-1737.
2-Фенил-6-этоксикарбонил-7-метилпиразоло[1,5-а]пиримидин (1).
2-Фенил-6-ацетил-7-оксипиразоло[1,5-а]пиримидин (2).
Спиртовый раствор едкого кали, приготовленный из 0.23 г (0.004 моля)
KOH и 10 мл абсолютного этанола, приливают к раствору 0.57 г (0.002 моля)
соединения 1 в 15 мл спирта. Мгновенно наблюдается
образование кристаллов, которые отфильтровывают, растворяют в минимальном
количестве воды и подкисляют разбавленным раствором HCl до pH 6. Образовавшиеся
кристаллы отфильтровывают, перекристаллизовывают из этанола и получают 0.34 г
(67 %) соединения 2, т. пл. 262-263 оС, Rf 0.63 (этанол).
Спектр ЯМР 1Н (DMSO - d6) d, м.д.: 3.22 (3H, c, CH3); 7.03 (1H, c, 3 - H); 7.41 (3H, м, 3ў,
4ў и 5ў - H); 7.91 (2H, м, 2ў и 6ў - H); 8.85 (1H, c, 5 - H) ; 13.18 (1H,
уш, OH). Спектр ЯМР 13C (DMSO - d6), d, м.д.: 14.39
(CH3); 93.87 (C3); 110.67 (C6); 126.11
(C3ў и C5ў); 128.1 (C2ў и C6ў); 128.58 (C4ў); 132.06 (C1ў); 144.26 (C7); 149.63
(Cipso); 149.92 (C2); 156.41 (C5); 165.55
(C = O). Масс-спектр, m/z (Iотн.%: 253 (M+,100), 252 (12), 236 (14), 209
(14), 208 (11), 144 (12), 142 (14), 127 (7), 77 (19), 67 (9), 28
(43).
2-Фенил-7-метилпиразоло[1,5-a]пиримидин (3). а) В 10 мл
водно-спиртового раствора 1.1 г (0.002 моля) едкого кали растворяют 0.8 г (0.4
ммоля) ацетилпроизводного 2 и кипятят 20 ч. По окончании
удаляют растворитель, остаток промывают бензолом, выделяя кристаллы соединения 3. Выход 100 мг (62%). Т.пл. 94-95 oС,
Rf 0.65 (бензол-ацетон, 3:1). Спектр ЯМР 1Н
(CHCl3), d, м.д., J (Гц): 2.85 (3H, ¶, J = 0,8, 7 - CH3); 6.68
(1H, ¶. кв, J1 = 0,8, J2 = 4.5,
6 - H); 7.00 (1H, c, 3 - H); 7.43
(3H, м, 3ў,4ў и 5ў - H); 8,05 (2H, м, 2ў и
6ў - H); 8.36 (1H,
¶, J = 4,5, 5 - H). Спектр ЯМР
13C (CHCl3), d, м.д.: 17.40
(CH3); 93.83 (C3); 107.56 (C6); 126.79
(C3ў и C5ў); 128.93 (C2ў и C6ў); 129.07 (C4ў); 133.24 (C1ў); 146.24 (C5); 148.72
(C7) 150.19 (Cipso); 155,92 (C2). Масс-спектр,
m/z (Iотн.%: 209
(M+, 18); 208 (100); 207 (21); 194 (6); 94 (6); 84 (21); 82
(13).
б) Аналогично предыдущему, соединение 3 получают с выходом 57% также из
этоксикарбонилпроизводного 1. По температуре плавления и
хроматографической подвижности оно соответствует образцу, полученному встречным
путем из ацетилпроизводного 2.
Получение йодида
2-фенил-4,7-диметил-6-этоксикарбонилпиразоло[1,5-a]-пиримидиния (4). В запаянной ампуле нагревают на водяной бане 3 мл метилйодида и 0.7 г (0.0025
моля) соединения 1. Через 4 ч ампулу вскрывают, выпаривают
досуха растворитель и остаток промывают гексаном. Получают 0.98 г (93 %) йодида 4, т.пл. 250-251 oС. Спектр ЯМР 1Н
(DMSO - d6), d, м.д.,
J (Гц): 1.48 (3H, m, J = 7.1, CH2CH3); 3.21
(3H, c, 7 - CH3); 4.46 (3H, c, N - CH3); 4.51 (2H, кв, J = 7.1, OCH2); 7.58
(3H, м, Ph); 8.03 (1H, c, 3 - H); 8.21 (2H, м, Ph); 9.74
(1H, c, 5 - H). Спектр ЯМР 13C (DMSO - d6), d, м.д.: 14.43
(CH2CH3; 17.71 (7 - CH3); 43.81 (N - CH3); 62.08 (CH2); 90.41
(C6); 107.18 (C3); 126.81 (C3ў и C5ў); 128.84 (C2ў и C6ў); 130.31 (C1ў); 130.43 (C4); 141.29 (Cipso);
148.40 (C5); 156.31 (C7); 157.70 (C2); 164.95
(CO).
2. Кост А. Н., Сaгитуллин Р. С., Данагулян Г. Г. - ХГС. 1977. N 4. C. 558-559.