УДК 548.0:539.27
Новые принципы создания наноразмерных материалов и
структур,
синтез нового класса аморфных наноразмерных материалов -
однокомпонентных металлов
(Представлено академиком А. А. Манташяном 18/III 2004)
Преодоление активационного барьера
практически любого химического превращения, как правило, осуществляется за счет
тепловой энергии или температуры реагентов, и поэтому константа скорости данного
процесса К имеет экспоненциальную аррениусовскую зависимость и растет с
температурой. Однако, как следует из физики атомных столкновений, увеличение
кинетической энергии сталкивающихся частиц приводит к уменьшению сечения
взаимодействия. Ситуация существенным образом меняется при привлечении
внутренней энергии взаимодействующих частиц для преодоления активационного
барьера реакции.
Первые же эксперименты с
пучками неравновесных колебательно возбужденных ионов [1,2], а также с
возбужденными молекулами [3,4] показали, что сечение взаимодействия или
константа скорости реакции, особенно в эндотермических процессах, возрастает до
104 и более раз, так как взаимодействие можно проводить при очень
малых кинетических энергиях, увеличивая время и вероятность взаимодействия до
максимума. Учитывая, что время столкновения в различных газообразных системах
при атмосферном давлении порядка 10-6 ё 10-7 с, становится
ясным, что для этих целей в качестве энергии возбуждения возможно лишь
применение метастабильных и колебательных уровней энергии с достаточной
продолжительностью жизни.
Проблема
заключается в том, что основные широко распространенные в природе молекулы
N2, O2, H2 и т.п., как и все другие гомоядерные
молекулы, а также симметричные молекулы типа CH4,
C6H6 и т.п. не имеют собственного дипольного момента и
поэтому обычным оптическим поглощением соответствующего кванта энергии возбудить
их невозможно. Предложенный нами новый, сравнительно простой способ возбуждения
таких бездипольных молекул [5] на различные квантовые уровни позволяет создать
предпосылки для разработки новой неравновесной технологии проведения различных
процессов. Для того чтобы отличить эти процессы от других, наиболее близких к
ним, например, процессов в плазмохимической технологии, она получила название
квантово-химической технологии (КХТ) [6,7].
Квантово-химическая технология отличается тем, что в отличие, например,
от плазмохимической технологии здесь взаимодействие обеспечивают неравновесные
молекулы с возможно низкой тепловой энергией. Заметим, что в плазмохимической
технологии, наоборот, основным фактором является именно высокая температура
реагентов, достигающая 5000oC и более [8]. В КХТ реагенты, имея
комнатную энергию на поступательных степенях свободы, могут обладать на
внутренних степенях свободы энергией до 20 000oС и более, на
соответствующих колебательных уровнях [9].
В
последние годы в КХТ стало возможным использовать и другие формы нетепловой
неравновесной энергии, например, "Grain Boundary Energy", возникающую в
различных наноразмерных системах [10]. Следует отметить, что поскольку
бездипольные молекулы, не имея оптических переходов, не имеют также и удобных
методов их наблюдения, нам вначале потребовалось создать специальные пучковые
установки [11] и методы наблюдения и измерения энергии их возбуждения [9] для
определения оптимальных условий генерации таких возбужденных молекул. Применение
неравновесной КХТ приводит к созданию наноразмерных порошков, в том числе
впервые синтезируются однокомпонентные металлы в аморфном состоянии.
Как известно, до появления КХТ основным и
практически единственным методом получения аморфных металлов являлось быстрое
охлаждение, "закалка" расплавов металлов со скоростями порядка 106
град/с. Однако такими способами закалки жидкостей однокомпонентные металлы в
аморфном состоянии получить невозможно, так как из-за их очень малой вязкости
требуется повышать скорость закалки до 1010-1013 град/с, что практически неосуществимо [12].
Существующими и достаточно изученными в аморфном состоянии являются различные
сплавы металлов (желательно с каким-либо хотя бы одним стеклообразующим
элементом, например, FeB, FeBSi и т.п.). Однокомпонентные аморфные металлы типа
Mo, W и др. в аморфном состоянии были синтезированы впервые именно методом КХТ1.
Основные
эксперименты проводились в скрещенном прокачиваемом реакторе, который
предварительно откачивался до давления 10-4
Торр. В одном направлении встряхиванием наклонного реактора подавались исходные
порошки, например, оксидов металлов - MeO (MoO3, WO3 и
т.п.), а в перпендикулярном направлении прокачивалась газовая смесь водорода с
активирующими добавками. В области скрещения реактора производилось возбуждение
молекул водорода в низкотемпературной плазме за счет использования элементарного
акта перезарядки. Из практических соображений с целью увеличения концентрации
возбужденных молекул нами в основном использовались молекулы водорода,
возбужденнные на третий колебательный уровень с энергией 1.5 эВ. Такая величина
энергии, как правило, была достаточной для восстановления основных имеющихся в
природе оксидов металлов. В зоне пересечения реактора при комнатной температуре
осуществляется реакция MeO + H2(v) ®
Me* + H2O, где Me* - металл в наноразмерном
аморфном состоянии. Образующиеся при этом пары воды откачивались вместе с
другими газообразными реагентами и выводились из зоны
реакции.
Получаемые таким образом
атомы металла также оказываются при комнатной температуре, которая и определяет
их дальнейшее фазовое состояние. Определение элементного и фазового состава
полученных металлов Me* являлось очень сложной самостоятельной
задачей, которая была решена с помощью совмещения термогравиметрических
исследований на венгерском дериватографе МОМ 1500 фирмы Перкин Элмер с вакуумным
прогревом металлического продукта до его кристаллизации. Дальнейшее определение
состава полученного металла производилось с помощью обычного
рентген-дифрактометра ДРОН-3. Для определения величины зерна и структуры
полученных наноразмерных материалов использовался также просвечивающий
электронный микроскоп BS-500 фирмы Тесла с ускоряющим напряжением 90 кВ и
разрешающей способностью 3-5 Å. Применение электронных
пучков в идентификации и исследовании наноразмерных материалов также имеет свои
особенности, определяемые тем, что при воздействии пучка наноматериалы, а
наноаморфные порошки металлов в особенности, активно взаимодействуют с ним,
преобразуя образцы и в ряде случаев обнаруживая новые неожиданные данные
относительно структуры наноразмерных систем и возможностей КХТ [13-15] по их
синтезированию.
Поскольку колебательно
возбужденные молекулы водорода обрабатывали и восстанавливали лишь поверхность
исходных оксидов, то процесс обработки требовалось проводить многократно, и при
этом рентген-спектр данного материала непрерывно понижался, в некоторых случаях
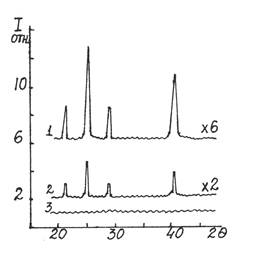
до полного исчезновения, как показано на рис.1. В некоторых случаях наблюдалось
появление широкого гало на углах соответствующего металла с полушириной
рентген-пика 4 ± 1 угловых градуса, что соответствовало
размерам зерна » 3 ё 4 нм,
вычисленным по формуле Шерера [25].

|
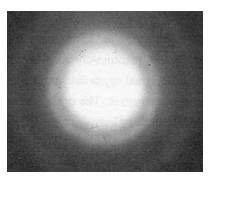
Рис. 1 Рис. 2
Такая же, и даже меньшая, величина зерна регистрировалась на электронном
микроскопе при электростатическом распаде наблюдаемых агломератов данного
вещества. Причем если при этом повышается интенсивность электронного пучка, то
образующийся из агломератов наноразмерный аморфный "песок" сразу же
кристаллизуется, как бы "закипая" на глазах мгновенно. Картина дифракции из
нормального, присущего аморфным состояниям гало (см. рис. 2) сразу же
трансформируется в точечные рефлексы, соответствующие монокристаллам, или в
тонкиe кольца, соответствующие поликристаллам этих
металлов.
Истинно аморфные порошки,
получаемые нами, при извлечении из реактора мгновенно загораются на воздухе, без
какого-либо нагрева, окисляясь до MoO2 в аморфном же состоянии.
Кристаллические аналогичные металлы, размельченные до таких же размеров,
загораются лишь при достаточно высоком нагреве - до 300 ё 400o С, а крупнозернистые частицы того же металла
Мо на воздухе практически не загораются до »
1000oС.
Нами проводились и
другие сравнительные изучения истинно аморфных и нанокристаллических (формально
аморфных, с разрушенной некристаллической поверхностью) металлов в химическом
синтезе высокотемпературных карбидов Mo и W, а также в катализе и в качестве
наполнителей в различных полимерах [16,17]. Во всех случаях наноразмерные
размельченные кристаллические металлы по своей активности резко уступали
активности наноразмерных бесструктурных истинно аморфных
металлов.
Применение добавок истинно
аморфных наноразмерных порошков Mo в процессе полимеризации полифенил сульфидов
позволило увеличить их износостойкость на порядок, тогда как добавки
нанокристаллических порошков Mo примерно таких же размеров повышали
износостойкость всего лишь на 20-30% [18]. Схожесть наших наноаморфных металлов
с "замороженным газом" проявляется также и в том, что в процессе синтеза часть
материала уносится потоком газов даже при незначительной скорости потока в
10-2 лТорр/с. Летучесть порошков является
очень важным свойством полученных нами металлов, так как таким образом решается
задача транспорта и нанесения наночастиц на различные подложки в
нанотехнологии.
Наблюдаемые
существенные отличия в свойствах и технологии полученных нами аморфных металлов
и известных кристаллических и аморфных металлов требовали введения новых
определений и понятий аморфности. Возникла необходимость пересмотреть
определения аморфности, основанные на сравнении с замороженной жидкостью с
достаточно протяженным понятием ближнего порядка до 10 ё 18 А [19,20]. Пришлось вводить новое определение для
синтезированных нами истинно аморфных порошков в виде сконденсированных
бесструктурных аморфных систем и вернуться к определению "frozen-gas", которое
ранее обсуждалось в [21,22], но было отклонено. Обоснование данного вывода
иллюстрируется рисунками активационных барьеров (рис. 3, а, б).
|
|
Рис. 3
Как
отмечалось выше, в КХТ неравновесные процессы осуществляются за счет
колебательной квантовой или других видов внутренней энергии, в условиях возможно
низкой температуры. Поэтому активационный барьер химического превращения (рис.3,
а) преодолевается не по траектории АВЕ (за счет тепловой энергии величиной DE), а по по траектории А'ВЕ, без дополнительной тепловой
энергии (за счет энергии колебательного возбуждения), и в случае эндотермических
процессов восстановления оксидов, например, MoO3 и WO3,
продукты реакции - свободные атомы металлов Mo и W приобретают комнатную
температуру, не превышающую 50 ± 20oС. На
рис.3, б представлен активационный барьер кристаллического зародышеобразования
[23], который в отличие от первого барьера (рис. 3, а) не может быть преодолен
за счет других видов энергии, кроме равновесной тепловой энергии, так как это та
энергия, которую необходимо иметь полученным атомам данного металла для создания
подвижности, диффузии и сближения этих атомов с целью создания кристалличекого
эмбриона с размерами большими, чем критический размер эмбриона Rcr
(см. рис. 3, б). Считается, что эта энергия расходуется на
создание поверхностной энергии кристалла [23]. При меньших энергиях газ в
системе не может конденсироваться и должен снова "откатиться" от барьера в
газовое состояние, а при обладании достаточной энергией атомы переходят барьер,
создавая кристаллическую фазу, при этом их равновесный размер должен быть больше
критического размера Rcr.
Таким образом, наноразмерность и аморфность вытекают естественным
образом из данной технологии. Очевидно, что для замороженных атомов, имеющих
комнатную температуру, величина Dm намного меньше и величина активационного барьера
оказывается достаточно большой, как и величина критического размера
Rcr. В литературе имеются данные по Rcr для кремния и
германия, которая составляет величину порядка 1.5-2.0 нм [24], а величина
барьера для перехода аморфного германия в кристаллическое состояние
соответствует температуре T = 500 K [25], при температуре его плавления T = 1000 K.
Можно сказать, что, как правило, величина барьера для перехода в кристаллическое
состояние DFcr на рис. 3, б составляет
величину порядка половины температуры плавления данного вещества. С уменьшением
величины зерна температура перехода в кристаллическое состояние, по-видимому,
уменьшается; для наших аморфных бесструктурных порошков вольфрама и молибдена
она понижается до Tcr і 1000 ё 1100 K.
Из
сказанного следует, что "замороженными" оказываются атомы металлов или других
продуктов неравновесных КХТ процессов, температура движения или энергия которых
меньше соответствующего последующего активационного барьера критического
кристаллического зародышеобразования. Совокупность таких бесструктурных атомов
можно назвать также истинно аморфным состоянием или сконденсированным газом.
Однако несомненно то, что такие наноаморфные порошки по своей микроструктуре и
свойствам отличаются от замороженных жидкостей и нанокристаллических порошков с
разрушенной поверхностной структурой, вследствие чего и требовалось ввести
соответствующее уточнение в определение аморфных веществ. Данное утверждение
было обсуждено и принято на международном симпозиуме сообщества материаловедов -
Material Research Society в 2003 г. специалистами по аморфным металлам [26].
Можно применить также название "аморфное состояние сконденсированного газа"
данного вещества, в отличие от известной конденсации газа в жидкость и затем в
кристаллическое состояние.
Обнаруженное нами явление конденсации атомов тугоплавких металов в
твердую фазу при комнатной температуре минуя жидкое состояние, привело к
созданию нового класса наноаморфных металлов (для сравнения отметим, что
конденсация атомов при температуре порядка 20 нано Кельвин является Бозе-
Эйнштейн конденсацией, при которой проявляются квантовые свойства
материала).
Разработанная нами
неравновесная КХТ, позволяющая отказаться от теплового нагрева реагентов, дает
возможность создать новый класс наноразмерных аморфных металлов. Определение
аморфных металлов (сплавов) как "замороженная жидкость" с наличием ближнего
порядка до 1.8 нм не может быть применимо к ним, так как наблюдаются качественно
различные физико-химические и микроструктурные отличия между ними. Применительно
к этим впервые полученным нами материалам предложено новое определение аморфных
бесструктурных материалов как конденсированный или "замороженный газ" в аморфном
состоянии. Закаленные аморфные расплавы металлов, в отличие от наших материалов,
как и ранее, можно называть "замороженными жидкостями" в аморфном
состоянии.
Выражаю благодарность
академику А. А. Манташяну за подробное обсуждение представленной работы и
полезные замечания.
Научно-производственное предприятие "АТОМ"
Литература
1. Малхасян Р. Т., Журкин Е.
С., Туницкий Н. Н. - Тезисы докл. 6-ой Всесоюзн. конф. по физике
электронных и атомных столкновений. 1975. Тбилиси. С. 177.
1Часть вышеуказанных работ до 1992 г. проводилась в Институте химической
физики НАН РА. Основные же работы в последующем были проведены в
Научно-производственном предприятии "АТОМ".
2. Малхасян Р. Т., Журкин Е.
С., Туницкий Н. Н. - Химия высоких энергий. 1977. Т. 11. N6. С.
400-402.
3. Бокун В. И.,
Чайкин А. М. - ДAН СССР. 1975. Т. 223. N4. С.
890.
4. Light G. C. - J. Chem. Phys. 1978. V. 68. P. 2831-2836.
5. Малхасян Р. Т., Мовсесян Г. Л. и др. Способ Малхасяна-Мовсесяна получения колебательно-возбужденных
бездипольных молекул. Авторское свидетельство 18186189 СССР// БИ 1990 г. N2. С.
20.
6. Малхасян Р. Т., Агабабян
Э. В., Караханян Р. К. - Химическая физика. 1995. Т. 15. N10. С.
8-16.
7. Malkhasyan R. T.
Grigoryan S. L. - Ceramic Transaction. 1996. V. 94. Р. 77-82.
8. Плазмохимические процессы.
Под ред. Л. С. Полака. М. Наука. 1979.
9. Малхасян Р. Т., Мовсесян Г. Л., Потапов В. К. - Химия высоких энергий. 1992. Т. 26. N1. С. 3.
10. Малхасян Р. Т. Способ создания аморфных металлов. Патент Армении N 828. 2000 г.
11. Малхасян Р. Т., Мовсесян
Г. Л. - ПТЭ. 1991. N4. С 176.
12. Судзуки К., Фудзимори Х., Хасимото К. Аморфные металлы. М. Металлургия. 1987. 328 с.
13. Малхасян Р. Т., Караханян
Р. К., Назарян М. Н., Чангмо Санг. - Кристаллография. 2003. Т. 48.
N3. С. 558-561.
14. Malkhasyan
R. T., Karakhanyan R. K, Nazaryan M. N., Changmo Sung - Proceedings of MRS FALL MEETING. 1900. V. 703. Р.
67-73.
15. Малхасян Р. Т.,
Караханян Р. К., Назарян М. Н., Чангмо Санг - Кристаллография.
2003. Т. 48. N3. С. 554-558.
16. Малхасян Р. Т., Гарибян Т. А. и др. - Метод получения
активных катализаторов. Патент Армении и Патент РСТ/АМ01/00009 2001.
17. Malkhasyan R. T. Krmoyan
R., Kosyan V. - Proceeding of MRS FALL MEETING. 2002. V. 734. Р.
168-173.
18. Malkhasyan R. T.,
Pogosian A., Makaryan V., Isajanyan A. - Proceedings of MRS FALL
MEETING. 2003. V. 795. P. 273-279.
19. Malkhasyan R. T. - Proceeding MRS FALL MEETING.1996. V.
400. P.77-82.
20. Ковнеристый
Ю. К., Осипов Э. К., Трофимова Е. А. - Физ.-хим. основы создания
аморфных метал. сплавов. М. Наука. 1983. С. 145.
21. Zhu X., Birringer R., Herr U., Gleiter H. - Phys Rev. 1987. B 35. R. 9085.
22.
Gleiter H. - Prog. Mater. Sci. 1989. V. 33. P. 223.
23. Chernov A., Givargizov E.,
Bagdasarov Kh., Demjanec L., Kuznecov V., Lobachev A. - Contemporaneous crystallography. 1980. V. 3. P.
51.
24. Wolf D., Philphot S.
R., Keblinski - Proc. of MRS FALL MEETING. 1996. V. 400.
25. Nanophase Materials,
Sinthesis - Properties - Applications. Ed. by Hajipanajis K. and Siegel R.
Kluwer Acad.Pudl. 1994. p. 808.
26. Malkhasyan R. T. - Proc. of MRS FALL MEETING. 2003. V.
806. P. 176-181.
Footnotes: