БИОХИМИЯ
УДК 616-006.446+616.155.32+577.11
В. В. Казарян, академик А. А. Галоян, П. А. Казарян, Л. С.
Саакян
Влияние гипоталамического обогащенного пролином
полипептида на
некоторые стороны метаболизма мембранных липидов при лейкозе у
коров
(Представлено 17/III 2004))
Cеть цитокинов играет в механизмах развития
заболеваний крови, в частности лейкозов, важную роль [1-4]. Между тем возможное
участие цитокинов в механизмах регуляции нарушенных метаболических процессов при
комплексной терапии лейкемии остается мало изученным. Так как
антинеопластические агенты способствуют повышению функциональной активности
лимфоцитов крови больных лейкозом, использование цитокинов может быть
обоснованным при лечении данной патологии.
Установлено, что гипоталамический
иммуноактивный пролинбогатый полипептид PRP, содержащий 15 аминокислотных
остатков [5-8], обладает мощным антибактериальным и нейропротекторным действием,
оказывает влияние на интерлейкин-2 зависимые функции лимфоцитов [9] в условиях
in vitro. Препарат оказывает явно выраженное корригирующее действие на
метаболизм мембранных липидов, в частности фосфолипидов (ФЛ) эритроцитов и
лимфоцитов крови и некоторых тканей [10-14]. Установлено также положительное
влияние PRP на миелопоэз [15] и дифференциацию Т-лимфоцитов [16].
В настоящей статье изучается влияние in vitro
PRP на некоторые стороны метаболизма мембранных фосфолипидов, инфицированных
вирусом лейкоза и больных лейкозом коров.
Исследования проводили на 30 коровах
черно-пестрой породы в возрасте 3-5 лет. Диагноз был поставлен на основании
эпизотологических и серологических данных, клинических признаков и результатов
патологоанатомических исследований. Лимфоциты выделяли в градиенте плотности
верографина (1.077 г/мл). Фракционирование индивидуальных ФЛ проводили методом
двумерной тонкослойной хроматографии [17]. Активность перекисного окисления
липидов (ПОЛ) определяли по реакции малонового диальдегида с тиобарбитуровой
кислотой [18], а активность фосфолипазы А2 - спектрофотометрическим
методом [19]. Препарат PRP вводили в условиях in vitro (на 1 мл взвеси
лимфоцитов добавляли 1 мкг PRP). Цифровой материал подвергался статистической
обработке с использованием критерия достоверности и различий Фишера-Стьюдента.
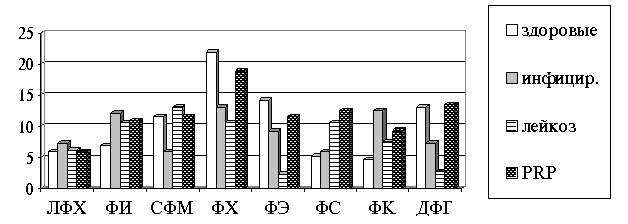
Лейкоз у коров характеризуется существенным
изменением состава ФЛ лимфоцитов крови (рис.1). При этом наблюдается
статистически достоверное снижение уровня фосфатидилхолинов (ФХ),
фосфатидилэтаноламинов (ФЭ), дифосфатидилглицеринов (ДФГ), сфингомиелинов (СФМ)
и увеличение уровня лизофосфатидилхолинов (ЛФХ), фосфатидилинозитидов (ФИ) и
фосфатидных кислот (ФК).
После применения полипептида PRP в условиях
in vitro в мембранах лимфоцитов наблюдается определенная нормализация
относительного содержания большинства фракций мембранных ФЛ. При этом уровень
ЛФХ, СФМ, ФХ и ДФГ почти полностью нормализуется.
Результаты исследований свидетельствуют о
значительном (p < 0.01) увеличении скорости ПОЛ в лимфоцитах крови коров, как
инфицированных вирусом лейкоза, так и уже больных лейкозом (рис.2). Резкое
усиление ПОЛ, по-видимому, можно объяснить уменьшением уровня антиоксидантов в
лимфоцитах периферической крови коров.
Можно предположить, что усиление ПОЛ,
вызывающее существенные нарушения в клеточном метаболизме, влечет за собой и
нарушение мембранной проницаемости для ионов кальция и тем самым способствует
активации фосфолипазы А2, что приводит к удалению токсичных
переокисленных жирнокислотных остатков фосфолипидов [20, 21]. После добавления
полипептида PRP в мембранах лимфоцитов прослеживается полная стабилизация
перекисеобразования, что в определенной степени можно объяснить
мембраностабилизирующим свойством PRP.
Лейкоз у коров сопровождается резким
повышением активности фосфолипазы А2 (рис.3). Вероятно, повышение
активности фосфолипазы А2 в лимфоцитах, катализирующей реакции
деацилирования фосфатидов-глицеридов, приводит к повышению пула
неэтерифицированных жирных кислот (преимущественно полиеновых ЖК), в частности
арахидоновой, которая вовлекается в различные метаболические процессы, в том
числе и в реакции свободнорадикального окисления с выходом большого количества
липидных перекисей. Последние же, в свою очередь, принимают участие в
патологических механизмах различных заболеваний, в том числе и лейкозов.
После применения PRP наблюдается выраженная
тенденция к нормализации активности фермента, что приводит к почти полной
нормализации уровня как ЛФХ, так и ФХ в лимфоцитах исследованных животных.
Учитывая широкий диапaзон регулирующего
влияния PRP на иммунокомпетентные клетки и гемопоэз [8], А. А. Галоян склонен
считать PRP уникальным фактором транскрипции ряда генов или стимулирующим
экспрессию фактором транскрипции [12,8].
Таким образом, полученные нами данные
позволяют заключить, что гипоталамический иммуноактивный пролинбогатый
полипептид PRP характеризуется мембраностабилизирующими свойствами и
определенной эффективностью в регуляции нарушенных метаболических процессов при
лейкемии у коров.
|
|
Рис.1. Изменения индивидуальных ФЛ (в % от суммы) в
лимфоцитах крови здоровых,
инфицированных вирусом, больных лейкозом животных и
после применения
гипоталамического полипептида PRP
Рис.2. Активность перекисного окисления липидов (в усл.
ед.) в лимфоцитах крови
здоровых (1), инфицированных вирусом (2), больных
лейкозом (3) животных и после
применения гипоталамического полипептида PRP
(4)
Рис.3. Активность фосфолипазы A2 (в усл. ед.) в
лимфоцитах крови здоровых (1),
инфицированных вирусом (2), больных лейкозом (3)
животных и после применения
гипоталамического полипептида PRP
(4)
Институт биохимии им. Г. Х. Бунятяна НАН
РА
Ереванский государственный
университет
Гематологический центр им. Р. О.
Еоляна МЗ РА
Литература
1. Mogattash S., Lutton L. D. -
Proc. Soc. Exp. Biol. Med. 1998. V. 291. P. 8-27.
2. Platanias L. C., Fish E. N.
- Exp. Hematol. 1999. V. 27. P.
1583-1592.
3. Weekx S. F., Van
Bockstaele D. R., Monlijin A., Rodrigus I., Lardon F., Bememan Z. N., Snock H.
W. - Exp. Hematol. 1999. V. 26. P.
1034-1042.
4. Galoyan A. A. Biochemistry of novel cardioactive hormones and immunomodulators
of the functional system neurosecretory hypothalamus - endocrine hearth. Nauka.
Moscow. 1997. P. 230.
5. Galoyan A. A. - Neurochemical Research. 2000. V. 25. N
9/10. P. 1343-1355.
6. Galoyan
A. A, Bedian I. V. Immunohistochemical Studies. Localization of
Hypothalamic Cytokine - PRP in Lymphatic Node, Thymus and Hearth.
Neurochemistry. 2001.
7. Galoyan A. A, Sarkissian J. S, Kipriyan T. K, Sarkissian E. J, Grigorian
Y. Kh., Sulkhanyan R. M., Khachatrian T. S. - Neurochem. Res.
2000. V. 25. N 12. P. 1567-1578.
8. Galoyan A. A. Brain Neurosecretory cytokines (Immune
response and Neuronal Survival). 2004. Kluner Academic Publishers. 200
p.
9. Galoyan A. A., Ghazaryan
A. P. - Neurochemistry. Poster. P7. Buenos Aires. 2001. Internet
Submitted Abstract Form No10179.
10. Галоян А. А., Казарян А. П., Казарян П. А. - Нейрохимия
(РАН и НАН РА). 2001. Т. 18. N4 C. 279-286.
11. Ghazaryan P. A., Galoyan A. A., Ghazaryan A. P. -
Proline-rich hypothalamic neurosecretory polypeptide stands up
against the irradiation pathology. Intern. Society for Neurochemistry (ISN) and
the Asian-Pacific Society for Neurochemistry (APSN), Hong-Kong. 2003. Abstr.
10459.
12. Казарян А. П.,
Казарян П. А., Галоян А. А. - Нейрохимия. 2003. Т. 20. N 1. С.
38-41.
13. Galoyan A. A. -
Int. Conf. "The role of the Biologically Activity of the Organism
in normal Conditions and in the Process of Adaptive Syndrome formation".
Yerevan. Armenia. 2003. P. 58-60.
14. Априкян В. С., Галоян А. А. - Медицинская наука Армении.
2000. Т. 39. N 4. С. 29-35.
15. Galoyan A. A., Aprikyan V. S. - Neurochem. Res. 2002. V.
27. N 4. P. 305-312.
16. Aprikyan V. S., Galoyan A. A. In: Biochemical and
Molecular Biological Aspects of the Brain Immune System * (Encyclopeadia
Armenian Publ. House). Yerevan. 2001. P. 22-34.
17. Казарян П. А., Элоян Д. В. - Хроматографические методы. М. ЦОЛИУВ. 1982. С.
40.
18. Ланкин В. З., Гуревич
С. М., Бурлакова Е. Б. В кн.: Биоантиокислители. М. 1975. С.
73.
19. Grassl M., Maellering
H. - Anal. Chem. 1969. V. 243. P.
416-423.
20. Козлов Ю. П. Свободнорадикальное окисление липидов в биомембранах. М. 1972.
21. Бурлакова Е. Б. - Материалы 6-й Междунар. конф. "Биоантиоксидант". М. 2002. С. 67-70.
