БИОХИМИЯ
УДК 577.15
Л. П. Тер-Татевосян, Л. В. Саркисян, И. Г. Асланян,
академик А. А. Галоян
Действие галармина и его производных на активность
неорганической
пирофосфатазы и щелочной фосфатазы органов белых крыс
(Представлено 8/IХ 2003)
Изучение ферментативных процессов
углеводно-фосфорного обмена и их регуляция в процессе развития организма имеет
важное значение для выявления ряда закономерностей общего биологического
характера. Фосфомоноэстеразы по праву можно отнести к числу самых
распространенных ферментов, осуществляющих в организме важную физиологическую
функцию ввиду участия в биохимических реакциях обмена веществ в процессе
фосфорилирования и дефосфорилирования. Динамику становления ферментативной
системы трудно понять без учета химических реагентов, в том числе эффекторов
биологического катализа - гормонов.
Выделенные А. Галояном и сотр. из
нейросекреторных гранул нейрогипофиза быка пролин-богатые полипептиды (ПБП),
обладающие выраженными иммуномодулирующими, нейропротекторными свойствами,
представляют несомненный интерес для исследования фосфомоноэстераз, которые по
сведениям некоторых авторов могут быть вовлечены в патологию ряда
нейродегенеративных болезней [1].
В настоящем исследовании использованы
полипептиды, состоящие из 10-15 аминокислотных остатков: пептид с 15
аминокислотными остатками - пролин-богатый пептид-1 (ПБП-1)
(Ala-Gly-Ala-Pro-Glu-Pro-Ala-Glu-Pro-Ala-Gln-Pro-Gly-Val-Tyr), названный
галармином; пептид с 14 остатками - пептид 174
(Ala-Gly-Ala-Pro-Glu-Pro-Ala-Glu-Pro-Ala-Gln-Pro-Gly-Val); пептид с 10
аминокислотными остатками с С-концевым свободным пролином - пептид 173
(Ala-Pro-Glu-Pro-Ala-Gln-Pro-Ala-Gln-Pro).
Цель работы - изучить влияние вышеуказанных
пептидов на активность фосфомоноэстеразы 1 - щелочной фосфатазы (КФ 3.1.3.1) и
неорганической пирофосфатазы (КФ 3.6.1.1) различных органов белых крыс в
условиях in vitro.
Были ипользованы те концентрации пептидов,
которые в условиях in vivo оказались эффективными при некоторых патологиях
(поражение центральной нервной системы, гемисекции, отравление змеиными ядами и
болезни крови). [1].
Опыты были проведены на печени, мозге и
почках белых крыс (самцов) весом 100-120 г. Животных декапитировали, на холоду
извлекали исследуемые органы и гомогенизировали определенное количество ткани в
дистиллированной воде микроизмельчителем типа Уоринга. Активность неорганической
пирофосфатазы определяли по методу Геппеля [2]. Реакционная смесь состояла из
0.01 М пирофосфата Na в мединаловом буфере (рН 7.2) и определенного количества
гомогената для разных тканей. 1 мл гомогената содержал 30-40 мг свежей ткани.
Активность неорганического фосфора определяли фотометрически при длине волны 630
нm, кювет 0.5 см.
Инкубацию проводили в течение одного часа при
температуре 370С. После инкубации приостанавливали реакцию 2 мл 40%
трихлоруксусной кислоты и в безбелковом фильтрате определяли неорганический
фосфор по методу Лоури и Лопеса [3].
Активность щелочной фосфатазы определяли
методом Шлыгина и Михлина [4]. В качестве субстрата использовали
пара-нитрофенилфосфат ("Reanal") в концентрации 2·10-3М в мединаловом буфере (рН 9.6). Об активности
фермента судили по нарастанию количества пара-нитрофенола в течение 30 мин при
300С.
Активность очищенного фермента щелочной
фосфатазы из тонких кишок цыплят (фирмы "Reanal") определяли так же, как и
активность тканевой щелочной фосфатазы (рН 9.6). Реакцию приостанавливали 1 мл
30% ТХУ, окраску восстанавливали слабой щелочью. Интенсивность окраски
фотометрировали при длине волны 420 нm, кювет 0.5 мм.
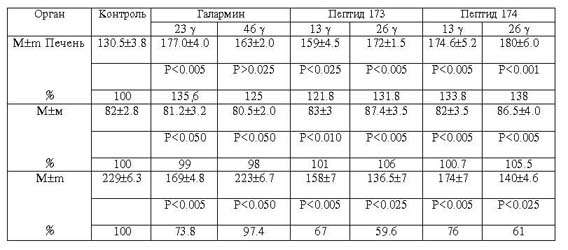
В первой серии опытов мы исследовали действие
галармина и его производных в определенном диапазоне доз на активность
неорганической пирофосфатазы в печеночной ткани (табл.1). Как показали
полученные результаты, высокие дозы пептидов повышают ферментативную активность
в среднем на 50%, низкие - на 15%, т.е. в данной ткани прослеживается четкая
корреляция между концентрацией пептида и активностью исследуемого фермента.
В почечной ткани активация неорганической
пирофосфатазы гипоталамическими пептидами прослеживается при всех использованных
количествах, достигая максимальной величины при воздействии пептида 174
(94%).
Таблица
1
Действие галармина и его производных на активность
неорганической пирофосфатазы
органов белых крыс (E = [(мкMP)/г,тк.,мин]), n = 7
Противоположная картина наблюдается в
мозговой ткани: галармин в дозах 46 и 23 g резко
ингибирует пирофосфатазную активность (36%). Пептиды 174 несколько слабее
подавляют фермент (25%), пептид же 173 при сравнении с контрольными животными не
оказывает воздействия на пирофосфатазную активность.
Таким образом, данные табл.1 показывают, что
галармин и его производные являются стимуляторами неорганической пирофосфатазы
печеночной и почечной тканей крыс, в то же время для фермента мозговой ткани эти
пептиды выступают в роли ингибиторов.
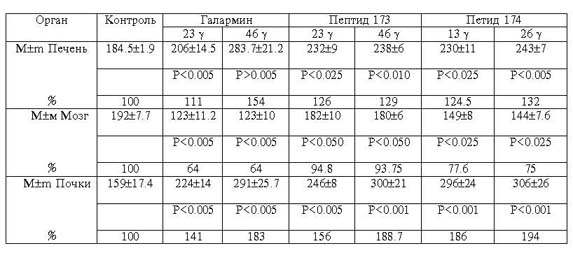
Таблица
2
Действие галармина и его производных на активность
щелочной фосфатазы органов белых
крыс (E = [(мкMP)/г,тк.,мин]), n = 7
Во второй серии опытов исследовалось действие
тех же полипептидов на щелочную фосфатазу печени, почек и мозга крыс (табл.2).
Как видно из таблицы, для печеночной ткани характерна однозначная активация
фермента при всех используемых дозах пептида. Концентрационная зависимость
каталитической активности щелочной фосфатазы почек от исследуемых пептидов
определялась в диапазоне 23-46g. Все пептиды четко
ингибируют фермент во всех концентрациях. Стойкую устойчивость к действию всех
использованных доз гипоталамических пептидов проявляет щелочная фосфатаза мозга.
Из литературы известно, что щелочная
фосфатаза слизистой тонких кишок некоторых животных обладает высокой
ферментативной активностью [5,6]. В этом аспекте интерес представлялo воздейтвие
биологически активных веществ на частично очищенный фермент слизистой тонких
кишок цыплят для сравнения с ферментом гомогената.
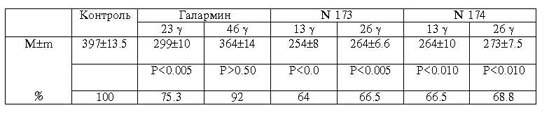
Данные этой серии экспериментов показали
(табл.3), что щелочная фосфатаза слизистой кишок сильнее подавлялась малыми
дозами пептида, т.е. для частично очищенного фермента ингибирующий эффект
действующего вещества находится в обратной зависимости от концентрации, что,
вероятно, связано с наличием нативных протекторов в очищенном препарате кишечной
щелочной фосфатазы.
Таблица
3
Действие галармина и его производных на активность
частично очищенного фермента
щелочной фосфатазы из слизистой кишечника цыплят
(E = [(мкMP)/мг белка, мин]), n = 6
Приведенные нами данные, касающиеся действия
гипоталамических пептидов на активность исследуемых ферментов, показывают,
насколько неоднозначно их воздействие. Возникает вопрос, каким механизмом
осуществляется их регуляция и какова природа фактора, блокирующего или
активирующего ферментативную активность.
Щелочная фосфатаза, выделенная из ряда
источников, по утверждению многих авторов, принадлежит к металлоэнзимам.
Известно также, что все аминокиcлоты в той или иной степени могут образовывать с
ионами металлов хелатные комплексы, принимая непосредственное участие в
образовании комплексов ионов металлов с белками [7]. В молекуле фермента, а
именно в его аллостерических и активных участках, под действием полипептидов
происходят некоторые структурно-конформационные изменения, в результате чего
фермент проявляет различную чувствительность по отношению к регулятору.
Кажущееся парадоксальным повышение активности
пирофосфатазы под влиянием всех трех пептидов в печени и почках зависит,
вероятно, от деятельности SH-групп, играющих важную роль как в проявлении
активности фермента, так и ее регуляции. SH-группы, соединяясь с пептидами,
могут повышать активность фермента по тому же механизму, что и в соединениях с
тяжелыми металлами [8]. Возможно, в механизме действия пептидов на
ферментативную деятельность существуют и другие пути.
По мнению академика А. Галояна, в одних
случаях это может быть С-концевой тирозин ПБП-1, который наряду с серином и
гистидином является точкой присоединения аниона фосфата, в других - наличие в
пептиде четырех пролиновых остатков, обеспечивающих активацию ферментативной
деятельности.
Представленный материал говорит о возможной
ферментативной регуляции щелочной фосфатазы и пирофосфатазы новыми
гипоталамическими пептидами, обеспечивающей уровень их функциональной
активности.
Институт биохимии им. Г. Х. Бунятяна НАН
РА
Литература
1. Galoyan A. Armen. In: Brain Neurosekretory cytokines, Immune Response and Neuronal
Survival. Kluwer Academic Publishers. 2004.
2. Heppel L. A. - Methods in Enzymology,
421, New York. 1955. V. 2. P. 570.
3. Lowry O. H., Lopez J. A. - J. Biol. Chem. 1946. V. 162.
N3. P. 421.
4. Шлыгин Г. К.,
Михлин С. Я. - Вопросы мед. химии. 1955. N1. C.
461.
5. Simpson R. T., Vallee
B. L. - Ann N. Y. Acad. Sci. 1963. V. 166 N2. P. 670-689.
6. Адунц Г. Т., Саркисян Л. В.
- Биол. ж. Армении. 1983. T. 35. N9. C. 769.
7. Hanson A. W., Applebury M.
L., Coleman I. E., Wyckoff., Richards F. M. - J. Biol. chem. 1970.
V. 245. P. 4975.
8. Адунц Г.
Т., Саркисян Л. В. - Биол. ж. Армении. 1975. T. 28. N9.