МОЛЕКУЛЯРНАЯ БИОЛОГИЯ
УДК 612.015.32: 611.12; 534.121.2; 616.127-005.8
Г. С. Казарян, С. С. Овакимян, академик К. Г. Карагезян
Нормализующeе влияние дс-РНК на расстройства метаболизма
нейтральных липидов в сердечной мышце и мембранах эритроцитов
при
экспериментальном инфаркте миокарда
(Представлено 20/V 2004)
Одним из основных факторов в патогенезе
инфаркта миокарда является нарушение структурно-функциональной целостности
мембран кардиомиоцитов [1-4]. Это главным образом обусловлено нарушениями в них
метaболизма различных фосфо- и нейтральных липидов (НЛ), в течение определенного
времени создающими благодатную почву для формирования грубых дегенеративных
повреждений сосудов в целом и коронарных сосудов в частности. Распад
фосфолипидов (ФЛ) способствует повышенному выходу неэтерифицированных жирных
кислот (НЭЖК) с последующим активным вовлечением их в реакции
свободно-радикального окисления, а также увеличению числа лизоформ ФЛ,
обладающих, как известно, мошным мембранолитическим действием. Наличие
отмеченных расстройств приводит к развитию многочисленных патологических
отклонений, в частности, понижению антиокислительной активности сывороточных
липидов, степeни их насыщенности, возрастанию содержания холестерина (Х) [5],
активации процессов перекисного окисления липидов, дефициту a-токоферола в аорте [6,7], стимуляции биосинтеза
фосфатидилхолинов (ФХ), сфингомиелинов (СФМ), фосфатидилэтаноламинов(ФЭ),
известных своими про- и антикоагулянтными свойствами [8,9].
Согласно литературным данным дс-РНК известнa
как индуктор интерферона, стимулятор первичного и вторичного иммунных ответов,
выступающий в роли мощного модулятора ряда жизненно важных биохимических реакций
клетки [10-13].
В данной работе исcледуется динамика
изменений содержания НЛ, Х и его эфиров при экспериментальном инфаркте миокарда
(ЭИМ) до и после введения дс-РНК.
Модель ЭИМ получали перевязкой нисходящей
ветви левой коронарной артерии [14]. Для опытов брали как интактных,
оперированных без введения дс-РНК животных, так и оперированных с внутрибрюшным
введением дс-РНК (в количестве 10 мг на 100 г массы тела животного). На 1, 3 и 5
дни после моделирования ЭИМ животных декапитировали в состоянии легкого эфирного
наркоза, изолировали некротизированный и перифокальный участки миокарда
(+100С), а также мембраны эритроцитов (МЭ). Методом тонкослойной
хроматографии на пластинках фирмы "Merck" определяли количественные изменения Х
и его эфиров, моно-, ди- и триглицеридов. Содержание изученных липидов
рассчитывали на денситометре фирмы "Pakard", а жирные кислоты (ЖК) определяли на
газхроматографе "Hitachi".
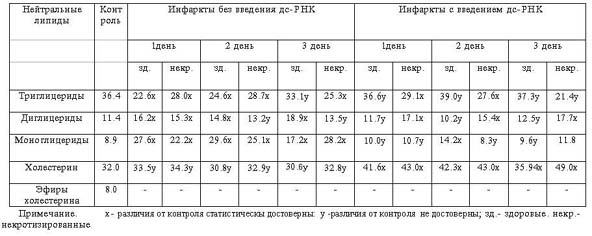
Установлено, что в регионах инфарктированной
миокардиальной ткани до лечения заметно увеличилось количество моноглицеридов
(на 50% от иcходного уровня); аналогичные, но менее выраженные изменения
наблюдались и в сдвигах содержания диглицеридов. Уровень триглицеридов
претерпевает противоположные изменения.
Как видно из табл.1, на фоне введения дс-РНК
в здоровой ткани миокарда отчетливо наблюдается упорядочение содержания моно- и
триглицеридов, без проявления аналогичных изменений в некротизированном участке.
Вместе с тем нам не удалось проследить сколь-нибудь заметных отклонений в
количестве Х и обнаружить присутствие его эфиров. Несколько иные сдвиги
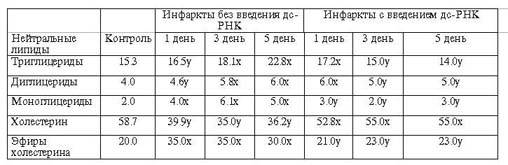
прослеживаются в МЭ (табл.2). При этом количество мембранных моно-, ди и
триглицеридов, по сравнению с контролем, заметно возрастает и полностью
нормализуется на фоне введения дс-РНК. В МЭ отмечается также значительное
увеличение количества эфиров Х, что, по всей вероятности, можно объяснить
возможным активированием реакций их ацилирования.
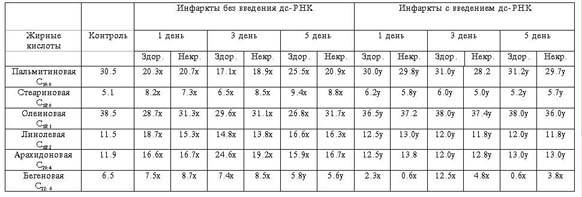
Как видно из табл. 3, в инфарктированной
сердечной мышце количества ненасыщенных ЖК увеличивается, за исключением
олеиновой кислоты, претерпевающей вместе со стеариновой незначительную тенденцию
к накоплению. Что касается остальных ЖК, в том числе и пальмитиновой, содержание
которой при изученной патологии понижается, то в результате введения дс-РНК их
уровень полностью восстанавливается. Изменения жирнокислотного состава НЛ в МЭ
носят более выраженный характер (табл.4).
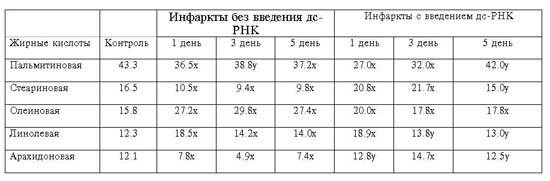
ЭИМ характеризуется уменьшением в миокарде
уровня насыщенных ЖК и возрастанием их содержания, особенно олеиновой кислоты.
Уже на 5-ый день после введения дс-РНК наблюдается упорядочение состава ЖК МЭ.
Расстройства в метаболизме НЛ миокардиальной ткани, наблюдающиеся при изученной
патологии, отличаются преимущественно отклонениями в качественных соотношениях
липидов, сопровождаясь также изменениями жирнокислотного состава данной
биологической системы. С другой стороны, не исключена роль дс-РНК как
эффективного регулятора реакций ацилирования и деацилирования Х, а также моно- и
диглицеридов.
Таблица
1
Количественные изменения нейтральных липидов в различных
участках сердечной мышцы
животных с острым инфарктом миокарда в различные
периоды его развития с и без
применения дс-РНК
Tаблица
2
Количественные изменения нейтральных липидов в мембранах
эритроцитов животных с
острым инфарктом миокарда в различные периоды его
развития с и без применения дс-РНК
Таким образом, многопрофильность регуляторных
воздействий дс-РНК на изученные звенья липидного метаболизма очевидна, о чем
свидетельствует упорядочение под его действием нарушенных сторон метаболизма НЛ.
По-видимому, в данном случае дс-РНК , с одной стороны, подавляет активность
ферментных систем деградации липидов, с другой, стимулирует ферменты,
катализирующие реакции биосинтеза этих соединений. Это, в частности,
подтверждается быстро развивающейся нормализацией качественного и
количественного состава НЛ и их жирнокислотного состава.
Tаблица
3
Количественные изменения жирных кислот (% от суммы) в
различных участках сердечной
мышцы животных с острым инфарктом миокарда в
различные периоды его развития с и без
применения дс-РНК
Tаблица 4
Количественные изменения жирных кислот (% от суммы) в
мембранах эритроцитов
животных с острым инфарктом миокарда в различные периоды
его развития с и без
применения дс-РНК
Институт молекулярной биологии НАН РА
Литература
1. Карагезян К. Г., Енгибарян
А. А., Акопян Ж. И., Овсепян Л. М., Овакимян С. С. - Мед. наука
Армении. Ереван. 1999. Т. 39. N1. С. 31-36.
2. Карагезян К. Г., Меликсетян Т. О. - Мед.
наука Армении. Ереван. 2000. T. 40. N1. С. 5-13.
3. Karageuzyan K. G., Kachatryan A. R. In:
Biochemical and molecular-biological aspects of the brain immune system.
Yerevan-Tsakhadzor. 2001. P. 48-54.
4. Балаян Б. Т., Алавердян А. Т. Hауч. труды 3 конгресса
кардиологов Армении. Ереван. 2001. С. 181-185.
5. Воскресенский О. Н. - В сб.: Липиды в
организме животных и человека. М. Медицина. 1974. С.
36-45.
6. Меерсон Ф. З.,
Малышев В. В., Каган В. Е. - Архив патологии. 1980. N2. С. 9-12.
7. Карагезян К. Г., Каган В.
Е. - Кардиология. 1981. N12. С. 55-60.
8. Бурлакова Е. Б., Джалябова М. И. - ДАН
СССР. 1978. Т. 241.
9. Бурлакова Е. Б., Архипова Г. В. В кн.: Биоантиокислители в
регуляции метаболизма в норме и патологии. М. Наука. 1982. С.
774-783.
10. Farrel P. G., Sen.
C. G. - Proc. Nat. Acad. Sci. USA. Biol. Sci. 1978. V. 75. P.
893-897.
11. Han I. H., Johnson
A. G. - J. Immunol. 1967. V. 117. P.
423-427.
12. Mathe G.,
Florentin I., Olsson L. - Ganser Treat. Rep. 1978. V. 62. P.
1613-1621.
13. Rather L.,
Wiegaund R. C. - Biochim and Biophys. Res. Commun. 1978. V. 81. P.
947-952.
14. Selye A. J.,
Bayers E. - Angiologie. 1960. V. 11. P. 398-405.