|
|
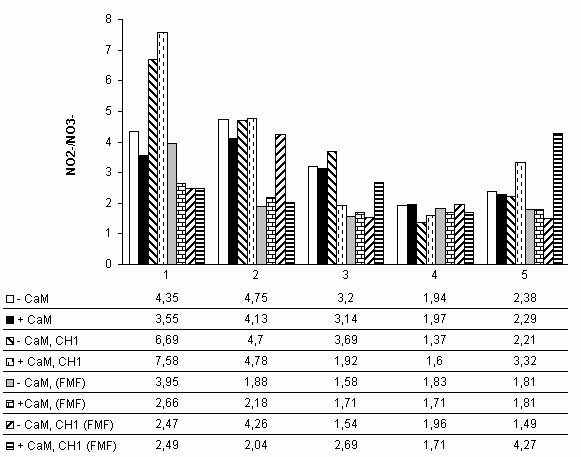
цельной крови здоровых женщин и больных ПБ (FMF). По оси абсцисс: 1 - кровь; 2 - тромбоциты; 3 -
нейтрофилы; 4 - лимфоциты; 5 - моноциты. По оси ординат: нитрит/нитрат анионы (мкг/мл крови,
время инкубации - 24 ч). Представлены средние результаты опытов.
На рисунке
представлены средние результаты анализа крови женщин: здоровых доноров и больных
ПБ, или семейной средиземноморской лихорадкой (FMF), с аутосомно-рецессивным
типом наследования, характерным для армянской популяции [14]. Не было обнаружено
прямой корреляции между интенсивностью продукции NO исследуемыми ФЭ и таковой в
цельной крови, что указывает на возможное взаимовлияние фракций, проявление
активности эритроцитарной NOS, а также влияние соединений плазмы на активность
NOS ФЭ [15]. В тромбоцитах помимо активности Ca2+/CaM-зависимой NOS-3
[1] была обнаружена Ca2+/CaM-независимая активность NOS, что,
возможно, обусловлено проявлением активности митохондриальной изоформы фермента.
У здоровых женщин во всех фракциях, кроме лимфоцитов, активность NOS в
отсутствие СаМ в инкубационной среде превалировала над таковой при наличии СаМ.
Возможно, в условиях долговременной инкубации клеток крови человека СаМ
оказывает дестабилизирующее влияние на фермент и/или имеет место более активное
метаболизирование NO. Апробированный нами препарат СН1 в отсутствие СаМ в
инкубационной среде снижал у здоровых женщин интенсивность образования NO в
лимфоцитах, моноцитах и в меньшей степени в тромбоцитах, одновременно повышая её
в нейтрофилах и цельной крови. СаМ изменял влияние СН1 на активность NOS в
лимфоцитах и моноцитах от ингибирования к стимулированию, а в цельной крови их
совместное действие способствовало ещё большему повышению активности фермента.
Инверсия действия СН1 на NOS в присутствии СаМ проявлялась в заметном снижении
аргинин-зависимого синтеза NO нейтрофилами. По-видимому, NOS-2 и
Ca2+/CaM-зависимые изоформы NOS отличаются по способности
метаболизировать СН1, и полученные нами результаты отражают особенности
изоферментного спектра NOS исследуемых клеток крови человека. На рисунке
представлен биохимический паттерн активности NOS ФЭ крови больных ПБ. У
пациенток с ПБ во всех исследуемых фракциях наблюдался пониженный уровень
активности NOS по сравнению со здоровыми женщинами, что может быть обусловлено
ретроингибированием фермента нитритами и/или цитруллином, содержание которых в
плазме больных ПБ было повышено (данные не указаны). Интересно, что в
нейтрофилах, играющих важную роль в развитии и течении воспалительной реакции
при ПБ, наблюдалась самая низкая активность NOS. У больных была резко снижена и
активность NOS тромбоцитов. Отметим, что NO активирует растворимую
гуанилатциклазу и подавляет экспрессию Р-селектина, влияя на взаимодействие
лейкоцитов и тромбоцитов и препятствуя их агрегации и адгезии в процессе
воспалительной реакции [1,4]. У пациенток с ПБ во всех ФЭ, кроме лимфоцитов,
активность NOS в присутствии СаМ была выше, чем без СаМ - картина, полностью
противоположная таковой у здоровых доноров. Интересно, что у больных ПБ CH1
значительно повышал продукцию NO тромбоцитами и лимфоцитами, тогда как в
отсутствие CaM он снижал активность NOS. И наоборот, в нейтрофилах и моноцитах
стимулирование активности фермента препаратом СН1 наблюдалось лишь в присутствии
СаМ (в 1.7 и 2.9 раза, соответственно). Институт биохимии им Г. Х. Бунятяна НАН
РА
1. Серая И. П., Нарциссов Я. Р.
- Успехи совр.биол. 2002. Т.122. N3 С.
249-258.
Институт милекулярной биологии НАН РА
2. Hickey M. J. -
Clin. Science. 2000. V. 100. №1. P. 1-12.
3. Alderton W. K., Cooper C.
E., Knowles R. G. - Biochem J. 2001. V. 357. № 3. P.
593-615.
4. Esh T., Stefano G.
B., Fricchione G. L., Benson H. - Med. Sci. Monit. 2002. V. 8. №
6. P. 103-118.
5. Licinio J.,
Prolo P., McCann S. M., Wong M. - Mol.Med. 1999. V. № 5. P.
225-232.
6. Фрик Г., Прейснер
З. С., Иенсен Г. Л., Бурмейстер Ю. В кн.: Иммунологические методы
(под ред. Х.Фримеля). М. Мир. 1979. c. 518.
7. Tracey W. R., Linden J., Peach M. J., Johns R. A. -
J. Farm. Exp.Ther. 1989. V. 252. № 3. P. 922-928.
8. Hrabak A., Bajor T., Temesi
A. - Biochem. Biophys. Res. Commun. 1994. V. 198. №1. P. 206-212.
9. McBride A., Brown G. C. -
FEBS Lett. 1997. V. 417. № 2. Р. 231-234.
10. Gagnon C., Leblond F. A.,
Filep J. G. - FEBS Lett. 1998. V. 431. № 1. P. 107-110.
11. Проскуряков С. Я., Бикетов
С. И., Иванников А. И., Скворцов В. Г. - Иммунология. 2000. Т. 4.
№ 1. С. 9-20.
12. Pryor W. A.,
Gueto R., Jin X., Koppenol W. H., Uppu R. M. - Free Radl.Med.
1995. V.18. P. 75-83.
13. Geller D. A., Lowenstein C. J., Shapiro R. A., Nussler A. K., DiSilvio
M., Wang S. C., Nakayama D. K., Simmons R. L., Snyder S. H., Billiar T. R. -
Proc. Natl. Acad. Sci. USA. 1993. V.90. P. 3491-3495.
14. Оганесян З. Р., Айрапетян
А. С., Шахсуварян Г. Р., Атаян К. Е., Саркисян Т. Ф. - Мед. наука
Армении. 2002. T. 42. № 2. С. 47-52.
15. Vallance P. - Nitric Oxide (R.J. Gryglewski, P.
Minuz, Eds.) IOS Press. 2001. V. 317. P. 53-56