|
|
УДК 576.311;611.82;616.076.4.854
О возможной кальций-регулирующей и синапсогенной
функции митохондрий нервных окончаний при паратиреопривной
тетании у
кошек
(Представлено академиком М.А. Давтяном 20/XI 2003)
Митохондрии (Мх), помимо своей главной
функции - выработки энергии для нужд клетки, имеют ряд дополнительных, не менее
важных функций. Так, они депонируют кальций, играют ведущую роль в процессах
апоптоза (программируемой смерти клетки) [1] и, связываясь между собой с помощью
особым образом устроенных контактов в митохондриальный ретикулум [2], могут
служить внутриклеточной кабельной системой для передачи электрических импульсов
[3]. Высказывалась также гипотеза о пластической функции Мх в процессе
формирования синапсов и десмосомовидных контактов [4], который складывается из
трех последовательных этапов, а именно: 1) образования прочной связи
синаптических мембран с участием выпрямленных белковых хвостов внутримембранных
липопротеидных частиц [5]; 2) повышения электронной плотности мембран будущей
активной зоны синапса путем адсорбции электронно-плотных гранул неизученной
природы, предположительно митохондриального происхождения, из нейроплазмы или с
поверхности синаптических пузырьков, транспортирующих эти гранулы; 3)
формирования парамембранных уплотнений находящимися по соседству
дезинтегрирующимися Мх. Вышеизложенное свидетельствует о том, что не все аспекты
деятельности этих органелл изучены достаточно полно, что и побудило обсудить в
данной работе проблему взаимоотношения Мх с активными зонами синапсов при
паратиреопривной тетании у кошек.
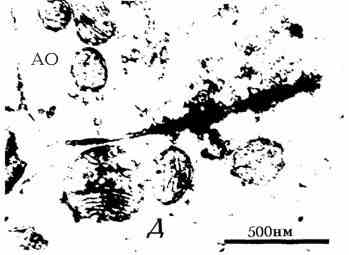
Результаты исследований показывают, что, помимо отмеченного ранее [6] значительного скопления Мх в области постсинаптической мембраны аксо-соматических синапсов, наблюдается очень близкое расположение некоторых из них по отношению к активным зонам синапсов. Более того, можно утверждать о формировании типичных контактов [2] этих органелл с синаптическими мембранами и парамембранными уплотнениями, в частности, аксо-дендритных синапсов (рис. 1). Одна Мх дендритного окончания контактирует с постсинаптической мембраной аксо-дендритного синапса, а две другие - с постсинаптическими уплотнениями, причем наружная мембрана одной Мх в зоне контакта разрушена (виден булавовидно утолщенный один ее конец). На рис. 2 одна Мх дендритного окончания контактирует с двумя постсинаптическими уплотнениями аксо-дендритного синапса. Нижний ее
|
|
полюс находится в состоянии распада, что позволяет допустить участие некоторых компонентов матрикса и мембран Мх в формировании различных структур активных зон синапсов de novo или их достраивании, в частности, парамембранных уплотнений, что впервые обнаружено нами при нормальном синаптогенезе в красном ядре кошки [4]. На рис. 3 показано очень близкое расположение Мх к плотным проекциям пресинаптической решетки (отмечено стрелкой). Гексагонально упакованные плотные проекции [7] срезаны в профиль и не строго по диаметру, а несколько косо, поэтому их величина постепенно уменьшается. По данным некоторых исследователей, они прикрепляются к гексагонально расположенным внутримембранным белковым якорным частицам пресинаптической мембраны (возможно, ими являются белковые хвосты липопротеидных внутримембранных частиц (ВМЧ) [5]) c помощью белков фодрина и анкирина [8]. Взаимосвязь синаптических пузырьков с цитоскелетом, их фиксация к пресинаптической решетке посредством белков синапсина I и II, квантовое выделение нейромедиатора (путем экзоцитоза), обратный захват неиспользованного нейромедиатора (путем эндоцитоза) регулируются ионами кальция [9], концентрация которого при изученной патологии была резко снижена в сыворотке крови у кошек. Известно [10], что перпендикулярное к плоскости мембраны расположение макромолекулярных цепочек или белковых хвостов ВМЧ [5] повышает проницаемость мембран вообще и в частности, в межмембранных [11] и межмитохондриальных контактах [2,5,12-13].
|
|
Приведенные данные позволяют допустить, что в
условиях паратиреопривной гипокальциемии описанные выше контакты Мх, возможно,
способствуют облегчению выброса депонированного в них кальция в активную зону
синапса для регуляции кальций-зависимого эндо-экзоцитоза медиатора в
синаптических пузырьках, для нормализации повышенной возбудимости нейронов или
предотвращения выпадения функции некоторых терминалей путем восстановления
химической медиации [6]. Кроме того, в отмеченном при данной патологии повышении
структурно-функциональной активности синапсов [6] Мх могут принимать,
по-видимому, и прямое участие (помимо энергетического обеспечения) путем
предполагаемой непосредственной поставки некоторых компонентов, необходимых для
увеличения числа активных зон, повышения их осмиофилии и утолщения синаптических
мембран, через сохранную или частично разрушенную оболочку, что расценивается
нами как проявление пластической функции Мх, впервые обнаруженной при
новообразовании синапсов в головном мозге кошек в норме [4]. Институт физиологии им. Л А Орбели НАН
РА 1. Замятина В.A. Организация внутриклеточных структур при апоптозе и действии
антиоксиданта. Автореф. канд. дис. М. 2001. 20
с.
ЦНИЛ Ереванского государственного
медицинского
университета им. Мхитара Гераци
2. Сударикова Ю.В. Ультраструктура митохондриального аппарата при алкогольной
кардиомиопатии. Автореф. канд. дис. М. 2000. 20
с.
3. Зоров Д.Б. Структурно-функциональное изучение механизмов живой клетки: кабельные
свойства митохондриальных систем. Докт. дис. М. 1988. 48 с.
4. Аглинцян Т.С. - Докл. VI съезда Арм. физиол. о-ва им. Л. A. Орбели. Ереван. 2001. С.
49.
5. Аглинцян Т.С. -
ДНАН Армении. 2000. Т. 100. N 4. С.
342-349.
6. Авакян Л.А.,
Худавердян Д.Н. - Архив анатомии, гистологии и эмбриологии.
1984. Т. 76. N 6. С. 15-20.
7. Vrensen G., Nunes Cardozo J., Muller L., Van der Want
- Brain Research. 1980. V. 184. P.
23-40.
8. Siman R., Baundary M.,
Lynch G. - Proc. Nat. Acad. Sci. USA. 1984. V. 81. P.
3572-3576.
9. Miyamoto S.
- Biochim. Biophys. Acta. 1995. V. 1244. N 1. P.
85-91.
10. Поликар А. Молекулярная цитология мембран животной клетки и ее микроокружение.
Новосибирск. Наука. 183 с.
11. Шахламов В. А. Капилляры. М. Медицина. 1971. 200
с.
12. Sweiger M., Herzog
V., Neupert V. - J. Cell Biol.
1987. V. 105. P. 235-246.
13.
Бакеева Л.Е., Ченцов Ю.С. - Итоги науки и
техники. Общие проблемы биологии. 1989. Т. 9. 103
с.
14. Семченко В.В., Боголепов
Н.Н., Степанов С.С. Синапсоархитектоника коры большого мозга
(морфометрические аспекты). Омск. ИПК. Омич. 1995.