БИОХИМИЯ
УДК 612.017.1.612.112.9
C. Г. Чаилян
Специфическая сорбция смеси полисахаридов на жестких
матрицах
(Представлено академиком А.А.Галояном 26/II 2004)
Анализ нуклеиновых кислот [1,2], их
фрагментов, определение содержания их предшественников и продуктов метаболизма в
клеточных экстрактах позволяют в некоторых случаях выявить ряд генетически
обусловленных заболеваний, таких как синдром Лех Нихана, дефицит ферментов
аденозин-дезаминазы, нуклеозид-фосфорилазы [3]. Данные, полученные при анализе
нуклеиновых кислот, используются при терапии раковых заболеваний [4,5].
В литературе широко представлены методы
выделения нуклеиновых кислот, в которых в основном используются катион-обменные
или слабо анион-обменные хроматографические материалы. Эти методы часто включают
в себя требования тщательного подбора величины рН, вида противоиона и его
концентрации, объема элюата и содержания в нем метанола, требования по учету
влияния температуры на время удерживания, степени набухания сорбента в целях
достижения приемлемой эффективности для разделения исследуемой пробы. Все это,
однако, приводит к увеличению продолжительности времени анализа и низкой
селективности разделения.
С появлением метода высокоэффективной
жидкостной хроматографии (ВЭЖХ) удалось удовлетворительно решить многие задачи,
связанные с выделением и очисткой нуклеиновых кислот и их фрагментов из
клеточных экстрактов. Однако анализ методом редупликации нуклеиновых кислот
(PCR) крайне затруднен из-за наличия в пробах примесей биоорганических
соединений, в частности полисахаридов. Обзор литературных данных привел нас к
предположению, что крайне эффективным способом сорбции полисахаридов может быть
использование системы ВЭЖХ с колонками на основе жестких матриц с афинным
лигандом на поверхности [6,7].
Целью исследований является создание колонок
систем ВЭЖХ для выделения нуклеиновых кислот, ферментов из биомассы в свободном
от полисахаридов гомогенном виде, для экспресс-анализа методом PCR.
В экспериментах были применены классические
методы выделения белковых экстрактов - обезжиривание, гомогенизация, фильтрация,
центрифугирование, лиофилизация [8-10].
В работе использовали жидкостный хроматограф
высокого давления LDC Analytical, насос Biotronic BT 8100, сканирующий детектор
(190-360 нм) Spectromonitor SM5000 и рефрактометрический детектор фирмы Кнауер.
Хроматограммы обрабатывали с применением программного обеспечивания SM5000
[11,12]. Сорбентом для работы послужил силикагель с размером частиц 5-7 мкм,
удельной поверхностью 200 м2/ г, суммарным объемом пор 1.2
см3/ г и диаметром пор 100Å, модифицированный
октадецилхлорсиланомн; на его поверхности был сорбирован лектин.
Метод получения и очистки лектина
представляет собой модификацию способа, основанного на аффинной сорбции лектина
завязей пшеницы на геле яичного белка (овогеле).
Приготовление овогеля. Яичный белок гомогенизируют и доводят до рН 5.0 с помощью 1 н уксусной
кислоты. Образовавшийся осадок удаляют центрифугированием. К прозрачному
раствору белка добавляют глютаровый альдегид до конечной концентрации 1% и
раствор оставляют на 3-5 ч при комнатной температуре. За это время
образуется опалесцирующий гель. Его тщательно размельчают в 1%-ном растворе NaCl
и промывают на сите этим же раствором от избытка глютарового альдегида. Для
блокирования остатков альдегидных групп гранулы геля заливают 1 М раствором трис
(гидроксиламинометан)-а и оставляют на 12 ч при -40 С. Затем к смеси
добавляют глицин до 2% и оставляют еще на 12 ч. После этого гель тщательно
промывают 1%-ным раствором NaCl, размельчают и с помощью сит отбирают фракцию
частиц размером 50-200 мкм. Для хранения гранулы заливают 1%-ным раствором NaCl,
содержащим 3% фенола. Фенол дубит гель и способствует его меньшему
набуханию в гипотонических или кислых растворах, используемых для элюирования
лектина. Перед употреблением гель отмывают от фенола и уравновешивают 10 мМ
фосфатным буфером c рН 7.2, содержащим 0.15 М NaCl.
Очистка лектина. 1000 г завязей пшеницы, обезжиренных петролейным эфиром, заливают пятью объемами
дистиллированной воды и смесь подкисляют 5 н HCl до рН 3.0. Экстракцию проводят
при комнатной температуре в течениe 1 ч при периодическом перемешивании.
Полученную суспензию центрифугируют при 600 об/мин в течение 15 мин и отбирают
надосадочную
|
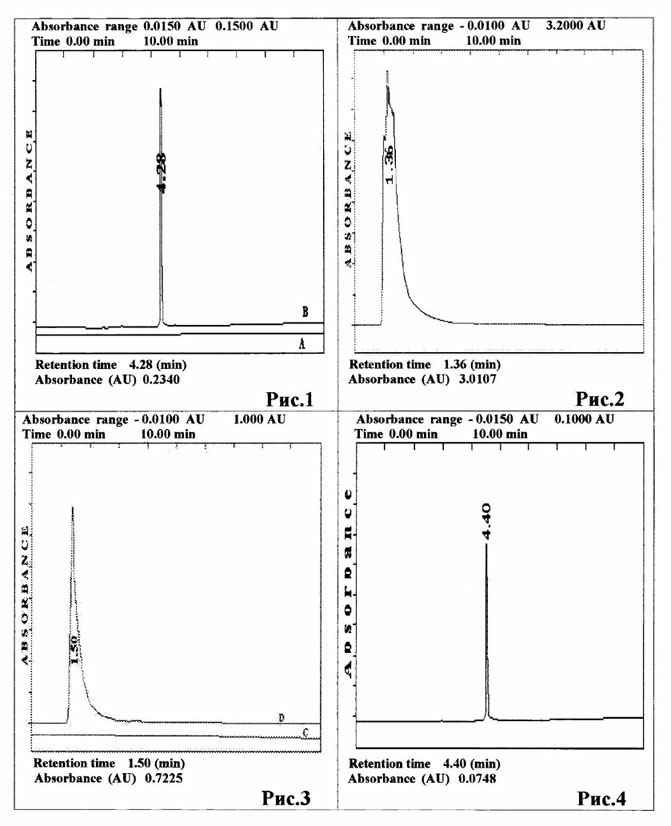
|
Рис.1. Хроматограммы: А - базовой линии после 2 ч
стабилизации колонки Биосфер SI100 C18 (250×4.6); элюент фосфатный
буфер pH 6.8/ацетонитрил (90/10). Объемная скорость 1мл/мин; температура 25±10С; обнаружение на UV при 200 нм; В - маточного
раствора смеси полисахаридов на колонке Биосфер SI100 C18 (250×4.6);
элюент фосфатный буфер рН 6.8/ацетонитрил (90/10). Объемная скорость 1мл/мин;
температура 25±10С; обнаружение на UV при
200 нм.
Рис.2. Хроматограмма маточного раствора лектина на колонке
Биосфер SI100 C18 (250×4.6); элюент фосфатный буфер рН
6.8/ацетонитрил (90/10). Объемная скорость 1мл/мин; температура 25±10С; обнаружение на UV при 280 нм.
Рис.3. Хроматограммы: D - маточного раствора лектина после
12 часов непрерывного прохождения через колонку Биосфер SI100 C18
(250×4.6); элюент фосфатный буфер рН 6.8/ацетонитрил (90/10). Объемная скорость
1мл/мин; температура 25±10С; обнаружение на
UV при 280 нм; C - базовой линии после 4 ч промывки колонки Биосфер SI100
C18 (250×4.6); элюент фосфатный буфер рН 6.8/ацетонитрил (90/10).
Объемная скорость 1мл/мин; температура 25±10С; обнаружение на UV при 280 нм.
Рис.4. Хроматограмма маточного раствора смеси
полисахаридов после иммобилизации лектина на поверхности колонки Биосфер SI100
C18 (250×4.6); элюент фосфатный буфер рН 6.8/ацетонитрил (90/10);
объемная скорость 1мл/мин; температура 25±10С; обнаружение на UV при 200 нм.
жидкость. Осадок повторно суспендируют в 2500 мл, подкисляют до
рН 3.0 и проводят дополнительную экстракцию в течение 30 мин. После
центрифугирования надосадочную жидкость объединяют с полученной ранее,
нейтрализуют до рН 6.5-6.8 с помощью 10%-ного NaOH и образующийся осадок удаляют
центрифугированием. Полученный прозрачный экстракт пропускают через колонку,
заполненную овогелем и уравновешенную 0.05 М К-фосфатным буфером с рН 6.8 в
течение 48 ч при 40С. Объем колонки выбирают из расчета 100 мл на 1 г
лектина (1 кг исходного сырья соответственно). После пропускания всего экстракта
колонку промывают 3-4 объемами 0.05 М К-фосфатного буфера рН 6.8.
Адсорбированный лектин элюируют 1%-ной
уксусной кислотой при комнатной температуре. В элюате определяли концентрацию
белка (А280 ) и титр гемагглютинации. Пик, соответствующий лектину,
отбирали, а фракции с низким содержанием лектина (менее 0.5%) отбрасывали.
Отобранный элюат нейтрализовали до рН 5.7 и оставляли для кристаллизации при
комнатной температуре. Обычно кристаллы появляются через 1-2 ч. После появления
кристаллов маточный раствор желтоватого цвета выдерживали 24 ч при
40С. Кристаллы собирали, центрифугированием при 200-400 об/мин. Для
возможно более полного удаления пигментов кристаллизацию проводили два раза.
Далее выделенный лектин быстро замораживали, проводили леофильную сушку.
Использованный метод существенно упрощает процесс получения лектина [12] и
улучшает качество продукта.
При электрофорезе в 7.5%-ном полиакриламидном
геле при рН 8.3 полученный препарат был представлен двумя полосами с содержанием
основного вещества 90%. Полученный лектин агглютинировал эритроциты человека в
титре 1:4096 независимо от группы крови. N-ацетил-D-глюкозамин угнетал
активность лектина в минимальной концентрации 5.5 мг/мл. Для растворения
препарата его навеску необходимо суспендировать в воде, подкислить в 0.1 н HCl
до полного растворения белка, а затем быстро перевести в 0.05 М К-фосфатный
буфер с рН 6.8. Для изучения сорбционных свойств лектина использовали водный
раствор полисахаридов фирмы Aldrich с молекулярными весами 500, 5000, 30000 и
100000 в концентрации по 6 г каждого на 100 мл раствора, что составило 24 г /100
мл (стандартный раствор).
Проведены сравнительные исследования
специфической сорбции полисахаридов на полученной нами колонке. Эксперименты
проводили в системе ВЭЖХ на колонке Биосфер Si100 C18 (250×4.6 мм)
при температуре 25±10С. Колонка содержала
3.1 г сорбента. Колонку с силикагелем, модифицированным октадецилхлорсиланом,
стабилизировали 0.05 М К-фосфатным буфером, рН 6.8/ацетонитрил (90/10), при
скорости потока жидкости 1 мл/мин в течение 2 ч. Отклонение нулевой линии не
превысило 0.01%, что свидетельствовало о равновесии системы. После чего на
колонку наносили 50 мкл стандартного раствора смеси полисахаридов. Элюирование
проводили 0.5 М К-фосфатным буфером, рН 6.8/ацетонитрил (90/10), при скорости
потока жидкости 1 мл/мин. Выход пика фиксировали на UV детекторе SM5000 при
длине волны 200 нм и рефрактометре фирмы Кнауер. Высота полученного
хроматографического пика поглощения составила 0.2340 AU и для дальнейших
расчетов была принята за единицу (рис.1). Лектин в количестве 100 мг растворили
в 300 мл воды. Оптическую плотность раствора измеряли при длине волны 280 нм, и
она оказалась равной 3.0107 AU (рис.2). Полученный раствор лектина прокачивался
по замкнутому циклу в течение 12 ч со скоростью 1 мл/мин через колонку,
модифицированную октадецилхлорсиланом и предварительно уравновешенную в течение
2 ч в системе 0.05 М К-фосфатный буфер, рН 6.8/ацетонитрил (90/10). По истечении
12 ч оптическая плотность элюата снизилась до величины 0.7225 AU, что
свидетельствует о сорбции 24 мг лектина на 3.1 г модифицированного силикагеля
(рис.3). Дальнейшая промывка колонки в течение 4 ч не обнаружила смыва
сорбированного лектина с поверхности колонки. После промывки колонки в течение 3
ч стабилизировали 0.05 М К-фосфатным буфером при рН 6.8 со скоростью потока 1
мл/мин. Далее пробу вводили в количестве 50 мкл стандартного раствора
полисахаридов. Элюацию проводили 0.5 М К-фосфатным буфером, рН 6.8/ацетонитрил
(90/10), со скоростью 1 мл/мин. Мы наблюдали уменьшение величины пика поглощения
стандартного раствора до значения 0.0748 AU. По сравнению с контролем она
уменьшилась на 30%, что свидетельствует о сорбции полисахаридов на поверхности
сорбента - силикагеля, модифицированного октадецилхлорсиланом и сорбированного
лектином на поверхности (рис.4).
Силикагель с размером частиц 5-7 мкм,
удельной поверхностью 200 м2/г, суммарным объемом пор 1.2
см3 /г и диаметром пор 100Å был модифицирован
октадецилхлорсиланом; в качестве аффинного лиганда был использован лектин.
Лектин был выделен по модифицированной методике из проростков пшеницы.
Предложенный метод позволил выделить лектин в кристаллическом виде с содержанием
основного вещества 90%. Эксперименты по хроматографии контрольного раствора
полисахаридов на колонке с силикагелем, модифицированным октадецилхлорсиланом, и
сорбированным лектином на его поверхности в системе ВЭЖХ показали, что
предложенная система эффективна для очистки растворов от полисахаридов. Удельная
емкость полученного сорбента по контрольному раствору смеси полисахаридов
составила 4 мг на 1 г сорбента.
Институт биохимии им. Г.Х.Бунятяна НАН
РА
Литература
1. Hernanto A. R. - Thesis. 1983. Tubingen University.
2. Chakhmakcheva O. G., Efimov
V. A., Ovchinnikov Yu. A. - Nucleic Acids Symp. 1980. N 7. P
345.
3. Boumahraz M., Davydov
V.Ya., Kiselev A.V. - J. Chromatographia. 1982. V. 15. P.
751.
4. Yang M.T., Milligan
L.P., Mathison G.W. - J.Chromatographia. 1981. V. 209. P.
316-321.
5. Orth P., Engelhardt
H. - Chromatographia. 1982. V. 15. P. 9-11.
6. Hjepre A., Antonopoulos C.
A., Classon B., Engfeldt B. - J. Chromatographia. 1980. V.
202. P. 453-460.
7. Kuo J. C.,
Yeung E. S. - J. Chromatographia. 1981. V. 223. P. 321-323.
8. Kainuma K., Nakakuki T.,
Ogawa T. - J. Chromatographia. 1981. V. 212. P. 126-129.
9. Daniel P. F., Lott I. T.,
McCluer R. H., In: Hawk G. L. (Ed.): Biological/ Biomedical
Applications of Liquid Chromatography. Marcel Dekker. Inc. NewYork. 1981. P.
363.
10. Hernanto A. R., Voelter
W., Bauer H., In: Proceeding XIth International Carbohydrate
Symposium. Vancouver. Canada. 1982.
11. Geigert J., Hirano D. S., Neidleman S. L. - J.
Chromatographia. 1981. V. 206. P. 396-405.
12.
Луцик М.Д. - Укр.хим.журн. 1984. Т. 56. N 4.
С. 432-434.
