В качестве аналогов хлорсульфурона ранее
синтезированы производные N-симм-триазинилокси (N-циан-N-симм-триазинил)-Nў-арил-(2-хлорсульфо-нил) мочевины, среди которых найдены
высокоактивные гербициды селективного действия [3,4].
С целью поиска новых гербицидов и в
продолжение указанных работ нами синтезированы N-пиримидинил-Nў-2,4-дихлорфеноксиацетил (2-метокси-3,6-дихлор-бензоил)
мочевины. Последние, помимо родственной связи с гетерилсульфонил-мочевинами,
могут быть отнесены к числу так называемых "прогербицидов", активность которых
проявляется в результате их начального метаболизма с образованием фитотоксичных
агентов, в данном случае указанных выше кислот (2,4-Д, Банвел-Д).
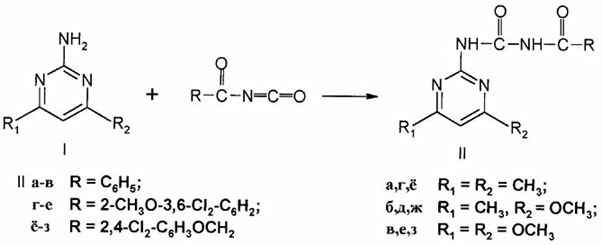
Синтез исходных соединений осуществлен действием ацилизоцианатов на аминопиримидины в присутствии каталитических количеств пиридина.
|
|
Необходимые ацилизоцианаты получены из соответствующих амидов с применением оксалильного метода синтеза изоцианатов[5]:
|
|
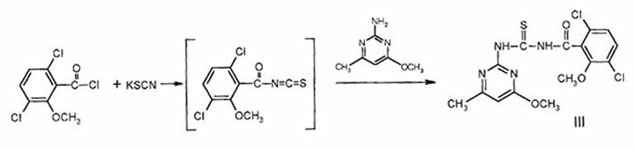
Учитывая возможность обессеривания производных тиомочевины с переходом в производные мочевины в биотических системах, определенный интерес представлял синтез соответствующих тиомочевин, полученных через ацилизотиоцианаты по схеме:
|
|
В
ряду полученных соединений особенно высокую гербицидную активность проявляет
N-(2,4-дихлорфеноксиацетил)-Nў-(4-метокси-6-метилпиримидинил-2) мочевина, которая в нормах
расхода 0.4-0.6 кг/га практически полностью уничтожает двудольный биотест
(редька) и не влияет на рост и развитие зерновых, не уступая при этом эталону -
амиду 2,4-Д(эмид) [6].
Спектры ЯМР 1Н растворов
соединений в ДМСО-d6 сняты на спектрометре ЯМР Mercury-300, чистота
полученных соединений определена методом ТСХ на пластинках Silufol UV-254.
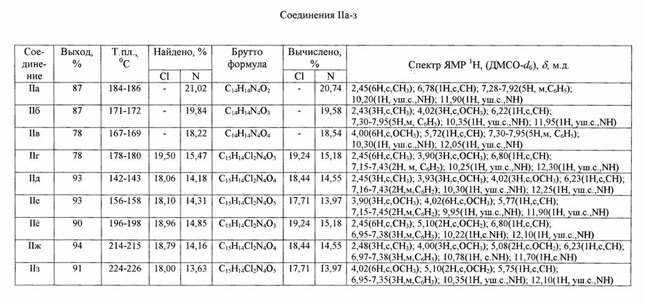
N-(4,6-замещенные
пиримидинил-2)-Nў-ацилмочевины(IIа-з). Смесь 0.01 моля
2-амино-4,6-замещенного пиримидина, 0.01 моля ацилизоцианата в 10 мл абс.
толуола и в присутствии каталитических количеств пиридина нагревают при
100-1100С 2 ч и оставляют на ночь. Фильтруют соединения IIа-з,
перекристаллизовывают из этанола (таблица).
N-
(4-метокси-6-метилпиримидинил-2)-Nў-
(2-метокси-3,6-дихлорбензоил) тиомочевина(III). Смесь 2.40 г (0.01 моля)
2-метокси-3,6-дихлорбензоилхлорида и 1.20 г (0.012 моля) роданида калия в 20 мл
диоксана нагревают при 1000С 1.5 ч, затем при той же температуре
прибавляют 1.40 г (0.01 моля) 2-амино-4-метокси-6-метилпиримидина. Нагревание
продолжают ещё 1 ч, затем охлаждают и приливают к холодной воде. Выпавший осадок
соединения III фильтруют и получают 3.2 г (80%) вещества, T.пл. 1900С
(C6H6). Найдено %: Cl 18.25; N 14.26; S 7.62.
C15H14Cl2N4O3S. Вычислено
%: Cl 17.71; N 13.97; S 7.98. Спектр ЯМР 1Н, (ДМСО-d6),
d, м.д.: 2.40 (3H, c, CH3); 3.95 (3H, c,
OCH3); 4.00 (3H, c, OCH3); 6.40 (1H, c, CH); 7.15-7.45
(2H, м, C6H2); 11.70 (1H, ш.c., NH); 13.10 (1H, ш.c., NH). Армянская сельскохозяйственная
академия 1. Баскаков Ю.А. - ЖВХО им. Д.И.Менделеева. 1984. Т.29. N1.
С.22.
2. Промоненков В.К.,
Сорокин В.И., Нестерова Л.М., Феодорова О.Н., Гранина Т.Е. Сульфонилгетерилмочевины. Обзор. инф. сер. "Химические средства защиты
растений". М. НИИТЭХИМ. 1985.
3. Довлатян В.В., Элиазян К.А., Казарян Э.А. - Арм.
хим. ж. 1987. Т.40. N12. С.749.
4. Довлатян В.В., Элиазян К.А., Пивазян В.А., Казарян Э.А. - Арм. хим. ж. 1988. Т.41. N7.
С.407.
5. Самарай Л.И., Белая
В.П., Галенко Г.Ф., Деркач Г.И. - ЖОХ. 1970. Т.6. N1.
С.85.
6. Мельников Н.Н., Баскаков
Ю.А. Химия гербицидов и регуляторов роста растений. М. 1962.
705 с.