МОЛЕКУЛЯРНАЯ БИОЛОГИЯ
УДК 661.732.9-611.81-599.323.4-616.379.608.64-771.74
Академик К. Г. Карагезян, А. Р. Едоян, Л. В. Едоян, Л. М.
Овсепян
Воздействие сверхмалых доз модифицированной двуспиральной
РНК
на жирнокислотный состав фосфолипидов мозговой ткани
аллоксандиабетических белых крыс
(Представлено 11/VI 2003)
Согласно научной информации последних трех
десятилетий [1-3] мозговая ткань млекопитающих отличается высоким уровнем
неэстерифицированных жирных кислот (НЭЖК), преимущественно полиенового ряда,
среди которых арахидоновая кислота занимает первостепенное положение. Указанные
соединения отличаются исключительно высокой степенью метаболической активности,
выступая подчас в роли физиологически активных веществ. НЭЖК в подавляющем
большинстве случаев определяются в составе важнейших мембраносвязанных
фосфолипидов (ФЛ), главным образом кислой природы, подвергающихся интенсивно
протекающим реакциям деацилирования под воздействием чрезмерно активированной
фосфолипазы А2, что особенно отчетливо проявляется при различных болезненных
состояниях организма, в том числе и аллоксановом диабете (АД). Сообщения о
существенном изменении жирнокислотного состава ФЛ мозговой ткани при сахарном
диабете [4] послужили основанием к проведению специальных исследований для
выяснения особенностей качественно-количественных изменений НЭЖК в мозговой
ткани подопытных животных с моделированным АД.
В последнее время успешно развивается точка
зрения об исключительной терапевтической эффективности так называемых сверхмалых
доз различных природных и синтетических физиологически активных соединений [5].
Многочисленные экспериментальные исследования подтверждают возможность
достижения высокого уровня коррегирующей активности при испытании указанных
соединений в концентрациях 10-12М и ниже
[6-8], а также использовании физических факторов сверхнизкой интенсивности.
Исходя из вышеизложенного в настоящем
исследовании нами были изучены особенности нормализующего действия сверхмалых
доз (10-12М) кальциевого преципитата
дрожжевой низкомолекулярной двуспиральной РНК (Ca2+-дс-РНК),
синтезированного в Институте молекулярной биологии НАН РА [9].
Исследования проводились на 45 белых
крысах-самцах (180-200г), подвергшихся однократному внутриперитонеальному
введению этанолового раствора аллоксана из расчета 15 мг/100 г массы тела.
Развитие ярко выраженного АД с высоким уровнем гликемической кривой,
соответствовавшим 10-20 дням после инъекции аллоксана, служило основанием к
реализации поставленной цели.
Животных декапитировали под легким эфирным
наркозом, изолирование головного мозга и приготовление мозгового гомогената
осуществляли в максимально ограниченное время в условиях холодной комнаты.
Выделение фракций нейтральных липидов осуществляли на колонке с силикагелем (Л
40-100, Чехия). После изолирования и метилирования НЭЖК диазометаном последующее
фракционирование проводили на колонках с силикагелем с использованием в качестве
элюирующей системы смеси гексана с этиловым эфиром в объемных соотношениях 99:1.
Определение метиловых эфиров НЭЖК проводили методом (Pay Unikam, Англия) на
колонках 1200-3 мм, содержащих 8% полиэтиленгликольадипината и 3% силиконового
каучука Е-30 на хроматографе с изотермическим (180oС) и градиентным
(170-240оС) температурными режимами. Для количественного подсчета
содержания отдельных фракций НЭЖК в качестве внутренних стандартов использовали
образцы невроновой и лигноцериновой кислот [10-12] производства "Сигма" (США).
Согласно результатам проведенных исследований
(табл. 1) развитая форма АД характеризуется проявлением высоких концентраций
НЭЖК в мозговой ткани, обеспечиваемых преимущественно за счет арахидоновой
кислоты. Многопрофильность метаболической активности последней проявляется в ее
вовлечении как в реакции биосинтеза многочисленных физиологически активных
соединений типа простагландинов, так и в процессе свободнорадикального окисления
(СРО) с формированием таких токсических продуктов, как моно-, ди-, триеновые
конъюгаты, гидроперекиси и малоновый диальдегид (МДА), обладающие ярко
выраженным мембранотоксическим, мембранолитическим действием. Интенсификация
процессов СРО липидов с выходом высоких концентраций указанных соединений
рассматривается как обязательный, но не специфический компонент патогенеза всех
болезненных состояний с различной степенью выраженности, в том числе и АД.
Таблица
1
Динамика количественных изменений неэстерифицированных жирных
кислот
насыщенного и полиенового ряда (в мг%) в мозговой ткани белых
крыс в контроле при аллоксановом диабете и под действием Ca2+-дс-РНК
в
течение 10-20дней
| Жирная кислота |
Контроль |
Диабет |
Ca2+-дс-РНК, 10 дней |
Ca2+-дс-РНК, 20 дней |
|
Пальмитиновая С16:0 |
28.8±0.52 |
17.09±0.61х |
19.11±0.56х |
23.0±0.55 |
|
Стеариновая С18:0 |
36.3±0.67 |
25.69±0.89х |
30.16±0.61х |
35.8±0.99 |
|
Олеиновая С18:1 |
37.1±0.78 |
30.55±0.63х |
33.12±0.62х |
36.6±0.71 |
|
Линолевая С18:2 |
6.9±0.39 |
4.77±0.44х |
5.11±0.29хх |
6.0±0.31 |
|
Линоленовая С18:3 |
5.2±0.27 |
3.00±0.29х |
4.00±0.25х
|
4.9±0.55 |
|
Арахидоновая С20:4 |
8.9±0.59 |
19.09±0.61х |
13.01±0.55х |
9.1±0.63 |
|
Сумма насыщенных жирных
кислот (С16:0+C18:0)-(A) |
59.1±0.79 |
42.78±0.81х
|
49.27±0.59х
|
58.8±0.81 |
|
Сумма ненасыщенных жирных
кислот A(C18:1+C18:2)
(С18:3+C20:4)-(B) |
58.1±0.57 |
57.27±0.55
|
55.24±0.55х
|
56.6±0.59
|
|
Коэффициент 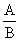
|
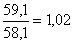 |
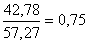 |
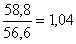 |
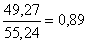 |
Примечание:
n=45, x
– P<0.001; xx
– Р<0.01;
без обозначений P>0.5.
Изучение особенностей изменений качественного
состава НЭЖК различных категорий в мозговой ткани аллоксандиабетических белых
крыс меняет укоренившиеся представления о роли жирнокислотного фактора в
формировании молекулярных механизмов этио-патогенеза АД. Уже на 10 день развития
АД наблюдалось отчетливо проявляющееся понижение уровня насыщенных пальмитиновой
(C16:0) и стеариновой (C18:0) кислот на фоне ярко
выраженного стабильного гипергликемического показателя. Отмеченный сдвиг мы
склонны объяснить интенсивным вовлечением C16:0 и C18:0 в
реакции ацилирования лизопроизводных ФЛ, преимущественно лизофосфатидилхолинов
(ЛФХ), образующихся в результате деацилирования ФЛ-глицеридов нейтрального ряда,
главным образом фосфатидилхолинов, под действием чрезмерно активированной
фосфолипазы А2. Этим и объясняется, с одной стороны, увеличение количества ЛФХ
при АД, с другой, - возрастание уровня НЭЖК полиенового ряда. Согласно табл. 1
отмеченный сдвиг оказывается наиболее демонстративным, как уже упоминалось выше,
в отношении арахидоновой кислоты, функциональная роль которой в головном мозгу
заслуживает пристального внимания [11], главным образом с точки зрения ее
активного участия в биосинтезе ряда физиологически активных соединений, например
простагландинов, а также в структурной организации инозитолсодержащих ФЛ
мозговой ткани млекопитающих, с подключением механизмов гормональной регуляции
[12-14], что служит поводом к переосмыслению ее роли в конкретизации
функциональных назначений этой группы ФЛ [15]. Результаты исследований последних
лет [16-19] проливают существенный свет на современное понимание роли
мембраносвязанных полифосфоинозитидов в реализации каскада постоянно
совершающихся процессов трансдукции внешних сигналов внутрь клетки как
факторов, стимулирующих системы клеточной активности.
Наряду с отмеченным развитие АД
характеризуется подавлением в головном мозгу активности
СДР-диацил-гликозил-инозит-фосфатидилтрансферазы, ведущим к чувствительному
ингибированию реакций биосинтеза полифосфоинозитидов [20]. Наиболее
примечательным следует признать срыв регуляторного воздействия указанной
категории кислых ФЛ на секреторную активность островков Лангенгарса [21], где
они выступают в роли метаболического посредника в интернализации гормонального
стимула инсулина на уровне инсулинзависимых тканей. Не исключена возможность
объяснения биохимического механизма количественного уменьшения
полифосфоинозитидов через механизм явно констатируемого повышения активности
соответствующих фосфолипаз [12], катализирующих процесс деацилирования
арахидоновой кислоты, выступающей в мозговой ткани как в роли одного из
важнейших физиологически активных соединений, так и в качестве весьма
податливого субстрата, интенсивно вовлекающегося в реакции перекисеобразования с
выходом арсенала токсических продуктов деградирующего действия на
структурно-функциональные образования клеток различных уровней их
филогенетической дифференциации.
Применение на фоне АД кальциевого преципитата
дрожжевой низкомолекулярной двуспиральной РНК (Ca2+-дс-РНК) в
сверхмалых концентрациях (10-12М) в течение
10 дней способствовало проявлению отчетливой тенденции к восстановлению исходных
уровней изучаемых веществ и их количественных соотношений, хотя и полученные
данные продолжали статистически достоверно отставать от контрольных величин.
В связи с отмеченным срок применения Ca2+-дс-РНК был продлен до 20 дней, что
способствовало окончательному упорядочению описанных нарушений в жирнокислотном
составе мозговой ткани животных с моделированным АД.
Примечательно, что аналогичные закономерности
были зарегистрированы и в динамике количественных сдвигов конечного продукта СРО
липидов - малонового диальдегида (МДА) (табл. 2).
Как вытекает из таблицы, при 10-дневном
действии сверхмалых доз Ca2+-дс-РНК происходит упорядочение
перекисеобразовательного процесса только в ферментативной - NADPH-зависимой
системе с заметным его ингибированием и в аскорбатзависимой системе образования
МДА.
Продление срока действия этого физиологически активного
аналога РНК до 20 дней приводит к полнейшей нормализации интенсивности течения процессов
СРО липидов и в неферментативной - аскорбатзависимой системе
перекисеобразования.
Таблица
2
Динамика количественных изменений продуктов переокисления
липидов
(в % МДА/мг белка) в мозговой ткани белых крыс в
контроле при
аллоксановом диабете и под действием Ca2+-дс-РНК
в течение 10-20дней
| Показатель |
Контроль |
Диабет |
Ca2+-дс-РНК, 10 дней |
Ca2+-дс-РНК, 20 дней |
|
Аскорбатзависимое переокисление |
100±2.3 |
149.5±2.5х |
137.3±2.3хх |
118.0±2.0 |
|
NADPH-зависимое
переокисление |
100±2.0 |
137.7±2.1х |
119.4±2.2 |
109.0±1.8 |
Примечание:
n=15, x
– P<0.001; xx
– Р<0.01;
без обозначений статистически недостоверны.
На основании полученных результатов можно
прийти к заключению об исключительной эффективности сверхмалых доз Ca2+-дс-РНК в
коррекции нарушений качественно-количественных превращений ЖК различных
категорий в мозговой ткани аллоксандиабетических белых крыс.
Институт молекулярной биологии НАН РА
Литература 1. Карагезян К. Г., Вартанян Г. С., Бадалян М. Г.- Бюлл. экспер. биол. и мед. 1980. Т. 90. С. 169.
2. Карагезян К. Г., Вартанян
Г. С., Паносян А. Г. - Нейрохимия. 1982. Т. 1. С.
139.
3. Мартикян А. Р.,
Вартанян Г. С., Карагезян К. Г. - Нейрохимия. 1984. Т. 3. N 3. С.
288-290.
4. Basan N. G. - Neurochemistry. 1979. V. 18. P. 1971-1974.
5. Бурлакова Е. Б. - Рос. хим. журн. (Журн.
Рос. хим. о-ва им. Д. И. Менделеева). 1999. Т. 43. N 5. С.
3-11.
6. Блюменфельд Л. А.-
Рос. хим. журн. (Журн. Рос. хим. о-ва им. Д. И. Менделеева). 1999.
Т. 43. N 5. С.15-20.
7. Ашмарин
И. П., Каразеева Е. П., Лелекова Т. В. - Рос. хим. журн. (Журн.
Рос. хим. о-ва им. Д. И. Менделеева). 1999. Т. 43. N 5. С.
21-28.
8. Пальмина Н. П.,
Мальцева Е. Л., Пынзарь Е. И., Бурлаков Е. Б. - Рос. хим. журн.
(Журн. Рос. хим. о-ва им. Д. И. Менделеева). 1999. Т.43. N 5. С.
55-63.
9. Свидетельство N 1367197 (Гос.
комитет СССР по делам изобретений и открытий) от 15 сентября 1987 г. на
изобретение: "Способ профилактики ящура у свиней" по заявке Ин-та
экспериментальной биологии АН АрмССР N 3862091, Москва, СССР.
10. Кейтс М.- Техника липидологии. М. Мир. 1975. 322 с.
11. Haye B., Jacjuemin C. - Biochim. еt
biophys. acta. 1977. V. 487. P. 231.
12. Sun G. Y., Der O. M., Tang W. - Lipids. 1979. V. 14.
P. 229.
13. Геворкян Э. С.,
Тадевосян Ю. В., Явроян Ж. В., Карагезян К. Г. - Укр. биохим.
журн. 1988. Т. 60. N 4. С. 81-83.
14. Геворкян Э. С., Тадевосян Ю. В. - Биохимия. М. 1990. Т.
11. Вып. 9. С. 1700-1706.
15. Тадевосян А. Ю. - Кооперативные механизмы
фосфоинозитидного пути и липидных модификаций при хроническом лимфолейкозе.
Автореф. канд. дис. 1999. 21 с.
16. Асатрян Л. Ю. - Кооперация процессов модификации липидного
компонента мембран лимфоцитов при инициации фосфоинозитидного цикла. Автореф.
канд. дис. Ереван. 1993. 30 с.
17. Тадевосян Ю. В., Батикян Т. Б., Асатрян Л. Ю., Карагезян К. Г.,
Тадевосян А. Ю. - Биохимия. М. 1996. Т.61. Вып. 8. С.
1414-1421.
18. Тадевосян Ю. В.
- Кооперативные процессы модификации липидного компонента мембран
в регуляции клеточной активности. Автореф. канд. дис. Ереван. 1996. 41
с.
19. Тадевосян Ю. В.,
Карагезян К. Г., Батикян Т. Б. - ДАН СССР. 1997. Т.295. N 5. С.
1254-1257.
20. Whiting P. H.,
Bowley M., Sturton R. G., Pritohard P. H., Brindley D. N., Nawthorne J. N. -
Biochem. J. 1977. V. 168. P. 147-149.
21. Best L., Malaisse W. J. - Biochim еt
biophys. acta. 1983. V. 750. P. 157.