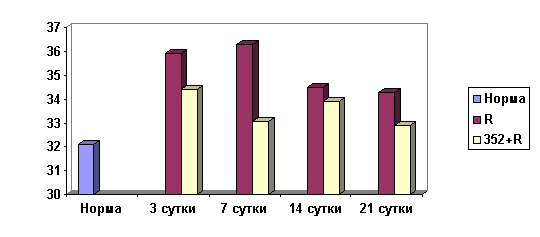
УДК 577.391;612.111;539.30
С.А. Баджинян1, М.Г. Малакян1, А.К. Абраамян1, С.А. Казарян2
Влияние аминокислотного хелата Мn(II) на некоторые
физико-химические параметры мембран эритроцитов при
радиационном
воздействии на организм
(Представлено академиком В.В. Фанарджяном 13/IX 2002)
Результаты многочисленных исследований
свидетельствуют, что биологические мембраны являются критическими структурами,
лучевые повреждения которых могут быть ответственными за летальный исход при
воздействии ионизирующего излучения [1-3]. Радиационно-индуцированные
повреждения биомембран проявляются в виде нарушений различных параметров их
структурно-функциональных свойств. Поэтому при поиске новых радиозащитных и
радиотерапевтических соединений существенным является исследование их возможного
регулирующего влияния на физико-химические характеристики клеточных мембран.
В настоящем сообщении представлены результаты
исследования радиопротекторной активности новосинтезированного хелата Mn(II) с
этиловым эфиром салицилиден-D,L-тирозина (в дальнейшем вещество К-352), о
наличии которой судили по способности этого соединения корригировать
функциональные свойства эритроцитарных мембран животных, подвергнутых облучению.
Предполагается, что этот комплекс, имеющий в своей молекуле несколько активных
функциональных групп, при введении в организм распределяется по тканям и клеткам
и проявляет антиоксидантные свойства при индуцировании ионизирующей радиацией
цепных реакций свободно-радикального окисления липидов клеточных мембран. В то
же время это соединение может способствовать как de novo синтезу, так и
восстановлению поврежденных радиацией металлсодержащих ферментов, принимающих
участие во многих жизненно важных биохимических процессах.
Исследования проводились на 70 половозрелых
белых беспородных крысах массой 180 - 200 г. Облучение проводили на
терапевтическом гамма-облучателе Со60 «Агат-Р» в дозе 4.8 Гр с
мощностью дозы 0.8 Гр/мин при кожно-фокусном расстоянии 40 см. Водную суспензию
вещества К-352 вводили животным подкожно в область брюшины за 1 ч до лучевого
воздействия в дозе 20 мг/кг.
Группой сравнения служили животные,
подвергшиеся только облучению, и интактные животные. Анализы проводились на 3-и,
7-е, 14-е и 21-е сутки постлучевого периода у 7 животных из каждой группы.
Исследовались следующие параметры мембран эритроцитов периферической крови
животных: мембранный потенциал, проницаемость для ионов калия и уровень
продуктов перекисного окисления липидов. Для измерения мембранного потенциала
(MП) эритроцитов применяли метод [4], который в широких пределах не зависит от
гематокрита и основан на электрометрическом определении равновесного
распределения водородных ионов снаружи и внутри клетки. Выходной поток калиевых
ионов из эритроцитов определяли с помощью К+-селективного электрода
по результатам нарастания концентрации К+ в изотонической среде NaCl
в течение 1 ч инкубации эритроцитов [5]. Уровень продуктов перекисного окисления
липидов (ПОЛ) определяли согласно методу [6].
Статистическую обработку полученных
результатов проводили на основе вычисления среднего арифметического значения и
стандартной ошибки.
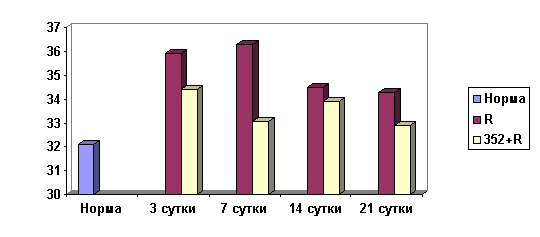
Рис. 1. Уровень продуктов ПОЛ эритроцитарных мембран
животных в различные
сроки постлучевого периода на фоне только облучения (R) и
при предварительном
введении препарата К-352 до облучения (352+R). По оси
ординат - концентрация
малонового диальдегида в нмоль/мл, по оси абсцисс - сроки
исследования
В развитии радиобиологических эффектов
ионизирующих излучений существенную роль играет активация свободнорадикальных
реакций цепного окисления липидов клеточных мембран под действием облучения.
Большое содержание полиненасыщенных жирных кислот в составе фосфолипидов
определяет высокую способность биологических мембран к реакциям окисления и
массовому накоплению избытка токсических продуктов окисления, в результате
которого развивается оксидативная деградация клетки.
Как и следовало ожидать, после воздействия
ионизирующего облучения в эритроцитарных мембранах животных обеих групп был
зарегистрирован высокий уровень активности процессов ПОЛ (рис.1). Однако у
животных на фоне инъекции вещества содержание продуктов ПОЛ во все сроки
исследования удерживалось на более низком уровне по сравнению с показателями
группы животных, получивших только облучение.
Исследование проницаемости эритроцитарных
мембран (рис.2) выявило увеличение этого показателя облученных животных во все
исследуемые сроки. Увеличение в два раза наблюдалось уже на 3-и сутки. Пик
изменений был отмечен на 7-е сутки. В дальнейшем, начиная с 14-ых суток,
патологические сдвиги в величине изучаемого показателя были менее выражены.
Введение животным препарата К-352 до подвержения их облучению способствовало
более слабому проявлению нарушений в проницаемости эритроцитарных мембран и
полному восстановлению величины этого показателя к концу срока наблюдения.
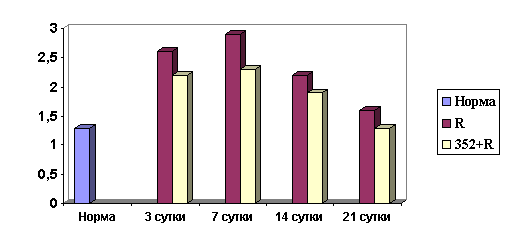
На рис. 3 приведена динамика изменения МП эритроцитарных мембран на 3-и, 7-е, 14-е и 21-е сутки постлучевого периода. Как видно из рисунка, радиация вызывает изменение изучаемого показателя. Так, МП эритроцитов животных, подвергшихся воздействию только ионизирующего излучения, во все исследуемые сроки был значительно выше по сравнению с нормой (интактные животные). В то же время МП эритроцитов животных, получивших препарат до облучения, во все сроки наблюдения хотя и был несколько выше нормы, однако ниже, чем у животных в контроле, с приближением к норме на 21-е сутки после облучения.
Рис. 3. Мембранный потенциал эритроцитов животных в
различные сроки
постлучевого периода на фоне только облучения (R) и при
предварительном
введении препарата К-352 до облучения (352+R). По оси ординат -
мембранный
потенциал в мВ, по оси абсцисс - сроки исследования
На основе полученных результатов можно
заключить, что хелат Мn(II) и этилового эфира салицилиден-D,L-тирозина обладает
определенным мембранопротекторным эффектом при воздействии на организм
ионизирующей радиации, обусловленным корригирующим действием изучаемого
соединения на такие мембранные свойства, как ионная проницаемость, мембранный
потенциал и уровень активности ПОЛ эритроцитов. Mожно предположить, что одним из
ключевых моментов в механизме радиомодифицирующего действия данного вещества
является его способность блокировать цепные реакции свободнорадикального
окисления липидов.
Работа выполнена в рамках проекта А-361 по
программе МНТЦ. 
1Научный центр радиационной
медицины и ожогов МЗ РА
2Институт
тонкой органической химии им. А.Л.Мнджояна НАН РА
1. Бурлакова Е.Б. - Информационный бюллетень Научного совета СССР по проблемам
радиобиологии. 1979. Т.22. С.3-4.
2. Баджинян С.А., Казарян П.А., Акопов С.Э., Саарян А.В. - Радиационная биология. Радиоэкология. 1995. Т.35. N3.
С.364-369.
3. Кудряшов Ю.Б.
- Радиационная биология. Радиоэкология. 2001. Т.41. N5.
С.531-547.
4. Macey R. et al.
- Biophys. Acta. 1978. V.512.
P.302.
5. Баджинян С.А., Геворкян
Э.Г., Генджян А.О., Погосян А.Г. - Журнал экспериментальной
и клинической медицины. 1989. Т.29. N1.
С.45-49.
6. Бенисович Ю.В.,
Идельсон Л.И. - Вопросы медицинской химии. 1973. Т. 19. N6.
С.596-599.