ОРГАНИЧЕСКАЯ ХИМИЯ
УДК 542.91+632.938
Академик В.В.Довлатян, Ф.В.Аветисян,
Т.Л.Дживанширян
Этиловые эфиры и
анилиды
арилоксиэтил-амино(тио)-4-метилтиазол-5-карбоновых кислот
(Представлено 30/X 2002)
В сообщениях, посвященных синтезу и
превращению замещенных тиазола и тиазолина, показано, что производные a-дитиокарбамоилацетоуксусной кислоты, полученные под
действием алкил(арил)-дитиокарбаматов натрия на этиловый эфир и анилид a-хлорацетоуксусной кислоты, при нагревании подвергаются
внутримолекулярной циклизации с образованием тиазолинов [1-3].
Представляло определенный интерес вместо
указанных дитиокарбаматов вовлечь в сферу данной реакции тиокарбамоильные
соединения, способные в изомерной тиольной форме реагировать с галогенидами, что
привело бы к образованию или солей тиурония, или продуктов их гетероциклизации.
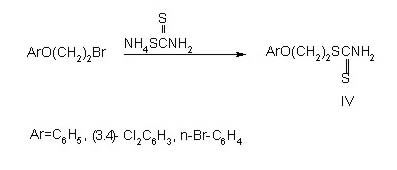
Для изучения этого взаимодействия в качестве исходных получены
арилоксиэтилтиомочевины(III) и S-арилоксиэтилдитиокарбаматы(IV), которые
благодаря наличию липофильных групп и тиокарбамоильной функции могут быть
отнесены к числу возможных фунгитоксикантов.
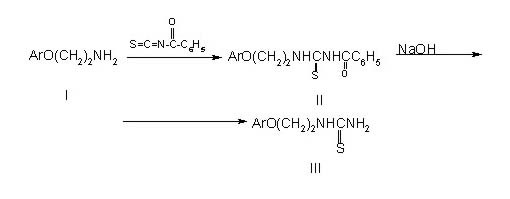
Показано, что под действием
бензоилазотоцианатов на ранее полученные арилоксиэтиламины(I) [4] образуются
N-бензоил-N'-арилоксиэтилтиомочевины(II), которые при дебензоилировании
переходят в искомые тиомочевины(III):
| Ar = C6H5,C6H4CH3 - o,C6H4CH3 - M,C6H4CH3 - n,C6H5CH2,C6H4Br - n, | |
S-Арилоксиэтилдитиокарбаматы(IV) получены при
взаимодействии арилоксиэтилбромидов с дитиокарбаматом аммония:
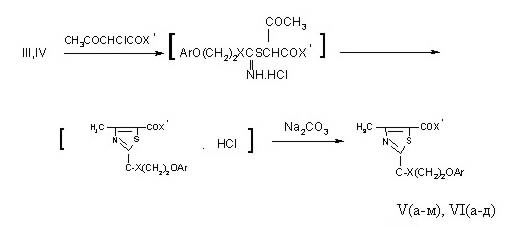
Установлено,
что при нагревании соединений III, IV с этиловым эфиром или анилидом a-хлорацетоуксусной кислоты в среде этилового спирта вместо
солей S-тиурония с открытой цепью образуются продукты их дегидратационной
внутримолекулярной гетероциклизации - этиловые эфиры и анилиды
2-арилоксиэтиламино(тио)-4-метилтиазол-5-карбоновых кислот (V, VI):
|
|
|
| V(а-м), Xў = NH,
X = OC2H5(а-е),
NHC6H5(ж-м),
Ar = C6H5(д,к),
| |
| (o) - CH3C6H4(a,ж), (м) - CH3C6H4(б,л), (n) - CH3C6H4(в,и), | |
|
С6Н5СН2(г,з), (n)
-
BrC6H4(e,м). |
| VI(а-д), X = S, Xў = OC2H5(а-в),
NHC6H5(г,д),
| |
| Ar = C6H5(а,г), (3,4) - CI2C6H3(б), (n) - BrC6H4(в,д) | | |
| |
Частота соединений контролировалась ТСХ на
пластинках «Silufol UI -254» (ацетон:гексан - 2:3), проявитель - 2%
AgNO3+0.4% бромфеноловый синий +4% лимонная кислота. ПМР спектры
сняты на «Varian T-60» (табл. 6).
N-(b-Феноксиэтил)-N'-бензоилтиомочевина (IIa).
К 0.85 г (0.012 моля) роданистого аммония в
ацетоне по каплям прибавляют 1.4 г (0.01 моля) бензоил хлорида, интенсивно
кипятят в течение 5 мин. Затем при умеренном кипении прибавляют 1.4 г (0.01
моля) b-феноксиэтиламина и продолжают кипячение еще
20-25 мин. Образовавшийся осадок промывают 75 мл воды, отфильтровывают,
высушивают. Получено 2.3 г IIa.
N-(b-o-Толилоксиэтил)-(IIб), N-(b-n-толилоксиэтил)-(IIв), N-(b-бензилоксиэтил)-(IIг), N-(b-м-толилоксиэтил)-(IIд), N-(b-n-бромфеноксиэтил)-(IIе) N'-бензоилтиомочевины получены
аналогично IIа (табл. 1).
b-Феноксиэтилтиомочевина (IIIа).
К 2.3 г (0.008 моля) IIа приливают 6 г
NaOH в 60 мл воды, хорошо перемешивают и подкисляют соляной кислотой. Осадок
отфильтровывают, высушивают. Получено 1.65 г IIIа.
b-о-Толилоксиэтил-(IIIб), b-n-толилоксиэтил-(IIIв), b-м-толилоксиэтил- (IIIд), b-n-бромфеноксиэтил-(IIIе) тиомочевины получены аналогично
IIIа (табл. 2).
Таблица 1
|
Соединение
|
Выход
в % |
Т.пл., 0 С
|
Найдено, % |
Брутто
формула |
Вычислено, % |
|
N |
S |
N |
S |
|
II а |
80 |
108-110 |
9,04 |
10,46 |
C16H16N2O2S |
9,33 |
10,66 |
|
II б |
85 |
100-101 |
9,10 |
10,15 |
C17H18N2O2S |
8,92 |
10,19 |
|
II в |
70 |
98-100 |
9,12 |
10,25 |
C17H18N2O2S |
8,92 |
10,19 |
|
II г |
82 |
108-110 |
9,02 |
10,05 |
C17H18N2O2S |
8,92 |
10,19 |
|
II д |
90 |
90-91 |
9,20 |
10,14 |
C17H18N2O2S |
8,92 |
10,19 |
|
II е |
73 |
125-127 |
7,31 |
8,28 |
C16H15BrN2O2S |
7,39 |
8,44 |
Таблица 2
|
Соединение
|
Выход
в % |
Т.пл., 0 С
|
Найдено, % |
Брутто
формула |
Вычислено, % |
|
N |
S |
N |
S |
|
III
а |
75 |
125-126 |
14,18 |
16,31 |
C9H12N2OS |
14,29 |
16,33 |
|
III
б |
78 |
128-130 |
13,15 |
15,40 |
C10H14N2OS |
13,33 |
15,24 |
|
III
в |
83 |
115-117 |
13,01 |
15,33 |
C10H14N2OS |
13,33 |
15,24 |
|
III
г |
80 |
125-127 |
13,28 |
15,38 |
C10H14N2OS |
13,33 |
15,24 |
|
III
д |
80 |
75-77 |
13,16 |
15,08 |
C10H14N2OS |
13,33 |
15,24 |
|
III
е |
76 |
104-106 |
10,08 |
11,49 |
C9H11BrN2OS |
10,18 |
11,64 |
2-N-(b-о-Толилоксиэтил)-4-метил-5-карбонэтокситиазол (Vа).
К 1.5 г (0.007 моля) IIIб в этаноле добавляют
1.4 г (0.0085 моля) этилового эфира a-хлорацетоуксусной
кислоты, нагревают при 78-80oС в течение 8 ч. Растворитель отгоняют,
добавляют воду, подщелачивают содой, осадок отфильтровывают, промывают водой,
высушивают. Получено 2.07 г Vа.
2-N-(b-м-Толилоксиэтил)-(Vб), 2-N-(b-n-толилоксиэтил)-(Vв), 2-N-(b-бензилоксиэтил)-(Vг), 2-N-(b-феноксиэтил)-(Vд), 2-N-(b-n-бромфеноксиэтил)-(Vе) -4-метил-5-карбонэтокситиазолы
получены аналогично Vа (табл. 3).
2-N-(b-о-Толилоксиэтил)-4-метил-5-карбонанилидотиазол (Vж).
К 1.5 г (0.007 моля) IIIб в этаноле добавляют
1.5 г (0.007 моля) анилида a-хлорацетоуксусной кислоты,
нагревают при 78-80oС в течение 8 ч. Растворитель отгоняют,
обрабатывают водой, подщелачивают содой, осадок отфильтровывают, промывают
водой, высушивают. Получено 2.3 г Vж.
2-N-(b-бБензилоксиэтил)-(Vз), 2-N-(b-n-толилоксиэтил)-(Vи), 2-N-(b-феноксиэтил)-(Vк), 2-N-(b-м-толилоксиэтил)-(Vл), 2-N-(b-n-бромфеноксиэтил)- (Vм)-4-метил-5-карбонилидотиазолы
получены аналогично Vж (табл. 3).
Таблица 3
|
Соединение
|
Выход
в % |
Т.пл., 0 С |
Найдено, % |
Брутто
формула |
Вычислено, % |
|
N |
S |
N |
S |
|
V а |
92 |
100-102 |
8,63 |
10,15 |
C16H20N2O3S |
8,75 |
10,00 |
|
V б |
92 |
110-112 |
8,50 |
9,60 |
C16H20N2O3S |
8,75 |
10,00 |
|
V в |
93 |
132-134 |
9,00 |
9,83 |
C16H20N2O3S |
8,75 |
10,00 |
|
V г |
82 |
77-79 |
8,91 |
10,03 |
C16H20N2O3S |
8,75 |
10,00 |
|
V д |
85 |
120-122 |
9,11 |
10,50 |
C15H18N2O3S |
9,15 |
10,45 |
|
V е |
75 |
177-178 |
7,20 |
8,25 |
C15H17BrN2O3S |
7,27 |
8,31 |
|
V ж |
80 |
183-185 |
12,11 |
9,29 |
C18H21N3O2S |
12,24 |
9,33 |
|
V з |
98 |
165-167 |
12,15 |
9,31 |
C18H21N3O2S |
12,24 |
9,33 |
|
V и |
84 |
206-208 |
12,01 |
9,15 |
C18H21N3O2S |
12,24 |
9,33 |
|
V к |
95 |
175-177 |
12,51 |
9,55 |
C17H19N3O2S |
12,76 |
9,73 |
|
V л |
85 |
201-203 |
12,21 |
9,30 |
C18H21N3O2S |
12,24 |
9,33 |
|
V м |
79 |
215-217 |
10,11 |
7,61 |
C17H18BrN3O2S |
10,29 |
7,84 |
S-b-Феноксиэтилдитиокарбамат (IV а).
К 1.0 г (0.005 моля) b-феноксиэтилбромида в среде диметилформамида добавляют 0.55
г (0.005 моля) дитиокарбамата аммония, нагревают при 50oС в течение 5
ч. Растворитель удаляют, остаток обрабатывают водой, отфильтровывают и сушат.
Получено 0. 8 г IVа.
S-b-(3,4-Дихлорфенокси)этил-(IVб), S-b-n-бромфеноксиэтил-(IVв), S-b-n-толилэтил-(IVг) дитиокарбаматы получают аналогично IV а
(табл. 4).
2-S-(b-Феноксиэтил)-4-метил-5-карбонэтокситиазол (VIа).
К 1.06 г (0.005 моля) Vа в среде этанола
добавляют 0.98 г (0.0059 моля) этилового эфира a-хлорацетоуксусной кислоты, нагревают при 78-80oС
в течение 8 ч. После удаления растворителя, остаток обрабатывают водой,
подщелачивают содой, отфильтровывают промывая водой, сушат. Получено 1.25 г VIа.
2-S-b(3,4-Дихлорфенокси) этил-(VIб), 2-S-b(n-дихлорфенокси) этил-(VIв)-4-метил-5-карбонэтокситиазолы
получают аналогично VIа (табл. 5).
Таблица 4
|
Соединение
|
Выход
в % |
Т.пл.,
0 С
|
Найдено, % |
Брутто
формула |
Вычислено, % |
|
|
|
N |
S |
|
N |
S |
|
|
IV
а |
75 |
128-130 |
6,29 |
30,20 |
C9H11NOS2 |
6,57 |
30,05 |
|
IV
б |
98 |
76-78 |
5,17 |
23,00 |
C9H9CI2NOS2 |
4,96 |
22,70 |
|
IV
в |
96 |
100-102 |
5,91 |
22,03 |
C9H10BrNOS2 |
4,79 |
21,92 |
|
IV г |
83 |
115-117 |
6,11 |
28,28 |
C10H12NOS2 |
6,19 |
28,32 |
Таблица
5
|
Соединение
|
Выход
в % |
Т.пл., 0 С
|
Найдено, % |
Брутто
формула |
Вычислено, % |
|
N |
S |
N |
S |
|
VI
а |
80 |
65-67 |
4,12 |
19,93 |
C15H17NO3S2 |
4,33 |
19,81 |
|
VI
б |
63 |
108-110 |
3,85 |
16,08 |
C15H15CI2NO3S2 |
3,57 |
16,33 |
|
VI
в |
89 |
73-75 |
3,19 |
16,11 |
C15H16BrNO3S2 |
3,48 |
15,92 |
|
VI
г |
81 |
70-72 |
7,45 |
17,27 |
C19H18N2O2S2 |
7,57 |
17,30 |
|
VI д |
85 |
180-182 |
6,18 |
14,35 |
C19H17BrN2O2S2 |
6,24 |
14,25 |
Таблица 6
|
Соединение |
Спектр ПМР, δ, м.д. ( ДМСО
–d6 ) |
|
II а |
4,10(2Н, м,
NCH2); 4,22 (2H,
т, OCH2 ); 6,85-8,02 ( 10H,
м, (C6H5)2
); 11,0 (2H, уш.с.,3-NH);
11,27 ( 1H, уш.с.,4-NH)
|
|
III а |
3,8 (2Н, уш.м,
NCH2), 4,10(2H,
т, OCH2 ); 6,80 (2H,
уш.с.,NH2); 6,85-7,27 ( 5Н,м,
C6H5
) ; 7,73( 1H, уш.с.,NH)
|
|
IV г |
2,25(3H,
c,CH3);
3,50(2H, т,SCH2);
4,10(2H, т,OCH2);
6,7-7,0(4H, м, C6H4);
3,05 и 9,3 (по 1Н,уш.с.,NH2)
|
|
V г |
1,32(3H,т.CH2CH3);
2,45(3H,с,CH3(цикл));
3,55(2H, м,NCH2);
3,65(2H, т ,OCH2);
4,20(2H,k,
CH2CH3);
4,53(2H,с,Ph-CH2)
7,2-7,35(5H,
м,C6H5);8,4(1H,ш.c.NH)
|
|
VI
а |
2,45(3H,c,COCH3); 2,64(3H,c,CH3(цикл));
3,63(2H,т,SCH2);
4,28(2H, т, OCH2);6,85-7,27(5H,м,
C6H5)
|
2-S-(b-Феноксиэтил)-4-метил-5-карбонанилидотиазол (VIг).
К 1.06 г (0.005 моля) Vа в среде этанола
добавляют 1.06 г (0.005 моля) анилида a-хлорацетоуксусной кислоты, нагревают при 78-80oС
в течение 8 ч. После удаления растворителя, остаток обрабатывают водой, сушат.
Получено 1.5 г VIг.
2-S-b(n-Бромфенокси)
этил-4-метил-5-карбонэтокситиазол (VIд) получен аналогично VIг (табл. 5).
Армянская сельскохозяйственная
академия
Литература
1. Довлатян В.В., Аветисян Ф.В.,
Папоян Т.З., Дживанширян Т.Л., Енгоян А.П. - ДНАН Армении.
2001. Т.101. N2. С.146-149.
2. Довлатян В.В., Элиазян К.А. и др. - ХГС. 2000. N5.
С. 677-681.
3. Довлатян В.В.,
Аветисян Ф.В., Папоян Т.З., Дживанширян Т.Л. - ДНАН Армении.
2002. Т.102. N1. С.57-61.
4. Довлатян В.В., Аветисян Ф.В., Геворкян Р.Р. - Тезисы
IV респ. конф. 1998. С.12.