УДК 541.124
Л.А. Манучарова, С.В. Царукян, академик И.А. Варданян
О возможности образования промежуточного комплекса при
гетерогенном
взаимодействии радикалов CH3O2с
метаном
(Представлено 19/V 2003)
За последние годы методами ЭПР и
ИК-спектроскопии на примере ацетальдегида и пропионового альдегида получены
данные, свидетельствующие о возможности реакций радикалов RO2 с
органическими соединениями на твердой поверхности [1]. Экспериментально
показано, что образование пероксидных соединений при газофазном окислении
альдегидов может происходить на поверхности реакционного сосуда [2,3].
Исследования газофазного окисления метана привели к выводу о возможности
гетерогенного образования гидропероксида метила CH3OOH вследствие
взаимодействия с метаном радикалов CH3O2 [4].
В настоящей работе поставлена задача найти
экспериментальные доказательства гетерогенного взаимодействия пероксидных
радикалов CH3O2 с метаном. Эксперимент осуществлялся в
условиях, исключающих гомогенное взаимодействие реагентов.
Реакцию радикалов RO2 с метаном
изучали при давлении 10-2 торр. на
установке, принципиальная схема которой представлена на рис.1.
Источником радикалов RO2 служила
реакция гетерогенного радикального распада [5] пероксиуксусной кислоты, которую
синтезировали по известной методике взаимодействием пероксида водорода (80%
конц.) и уксусного ангидрида [6]. Подачу и дозировку
CH3CO3H осуществляли с помощью емкости (4) и манометра
(3). Заданные количества CH3CO3H при T=78 К адсорбировали
на поверхности шарообразной колбочки (1) с d=38 мм, предварительно обработанной
насыщенным водным раствором борной кислоты. В условиях данного эксперимента
количество адсорбированной пероксикислоты изменялось в пределах 2-5 торр.
Радикалы RO2 генерировались
нагреванием адсорбированной пероксикислоты. В качестве твердой поверхности была
выбрана соль KCl. Поверхность капиллярного реактора (2) была обработана 10%
раствором KCl. Стабилизация поверхности осуществлялась обработкой ее потоком
радикалов.
|
|
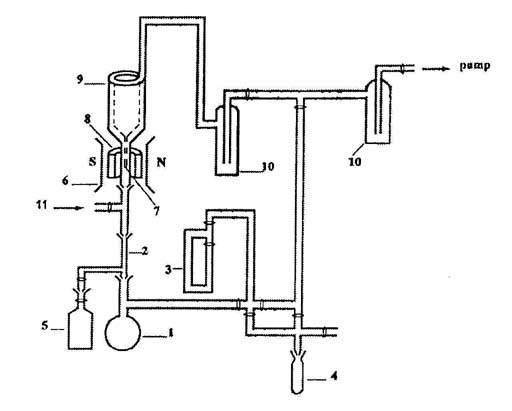
Рис. 1. Схема установки: 1 - кварцевая колба для адсорбции
пероксикислоты,
2 - реактор, 3 - манометр, 4 - емкость с пероксикислотой, 5 -
емкость для
реагентов (CH4), 6 - магнит, 7 - палец, 8 - резонатор
ЭПР, 9 - кварцевый
сосуд Дьюара, 10 - ловушка, 11 - отвод для подачи реагентов.
Радикалы RO2
направлялись через реактор (2) на узел вымораживания, помещенный в резонаторе
ЭПР -спектрoметра и анализировались по методике, описанной в [7,8]. Реагенты
подавали через специальный отвод из емкости (5), объемом 7.6 см3. При
этом была предусмотрена возможность подачи реагентов как у входа в реактор, так
и после него (11). Последний вариант подачи позволял следить за наличием или
отсутствием гомогенной составляющей реакции в коммуникациях. Размер и
конструкция реактора (капиллярная трубка из пирекса, l=20 мм, d = 1.5 мм), а
также низкое давление в опытах исключали гомогенное протекание реакции. Время
пребывания реагирующей смеси в капилляре (t =
10-5-10-6 c) выбиралось намного меньше времени гомогенного
взаимодействия радикалов CH3O2 с метаном (t1) [9,10]. Отсутствие взаимодействия пероксидных
радикалов с реагентами в коммуникациях после реактора было установлено
специальными опытами путем подачи реагентов в эту зону. Расход радикалов в этом
случае не наблюдался. Рис. 2. Зависимость расхода радикалов
CH3O2 от количества поданнoго CH4 при T = 297К.
В экспериментах варьировали как давление
подаваемого в реактор газа, так и температуру реактора. Концентрация метана
(99.99%) в системе варьировалась в интервале от 0 до 9.7×1017
молекул, а исходная концентрация RO2 радикалов не изменялась. Рис. 3. Зависимость расхода радикалов
CH3O2 от температуры при подаче CH4, Это может быть причиной наблюдаемого
постоянства скорости газофазного окисления метана и сильного влияния природы
поверхности реакционного сосуда на направление и скорость реакции [12,5].
Институт химической физики НАН РА
Литература 1. Bakchadjyan R. H., Vardanyan
I. A. - IJCK. 1994. V.26.
P.595.
Распад пероксиуксусной кислоты изучали в
интервале температур от 540 до 570 К, а продолжительность нагрева - от 0.5 до 2
мин. В результате было установлено, что оптимальными для получения необходимого
количества радикалов RO2 в газовой фазе являются температура, равная
538 К, и нагрев в течение 1 мин. Количество накопленных в узле вымораживания
радикалов составляло ~ 1015 частиц.
Температура в зоне капиллярного реактора обычно была ниже ( Ј 353 К) температуры в зоне генерирования радикалов. Таким
образом, роль вторичных процессов в капиллярном реакторе была сведена к
минимуму. В работе [11] на примере радикалов CH3CO3 было
показано, что на поверхности, обработанной KCl, до температуры 373К гетерогенная
рекомбинация не наблюдается. В экспериментах в пределах ошибок опыта при
увеличении температуры реактора до 353К и поверхности реактора вдвое практически
не обнаружили заметной гетерогенной реакции. Следовательно, в присутствии
реагента расход радикалов может быть отнесен к реакции взаимодействия с
реагентом. О взаимодействии радикалов с метаном судили по расходу радикалов
RO2 по отношению к их исходному количеству. Воспроизводимость
результатов была удовлетворительной.
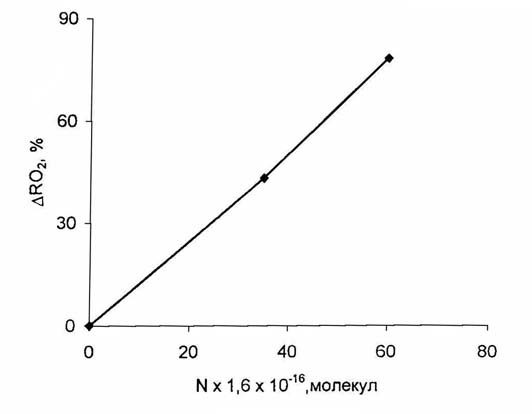
Опыты показали, что в присутствии метана уже
при 297К наблюдается заметное превращение пероксидных радикалов (рис.2). Как
видно, если при подаче метана 5.6×1017 молекул расходуется 43%
радикалов RO2, то в случае увеличения подачи метана до
9.7×1017 молекул расход радикалов RO2 достигает 78-80%.
Нужно отметить, что при последовательной подаче нескольких порций метана в узел
вымораживания радикалов количество намороженных радикалов уменьшается
соответственно количеству поданного метана. Влияние температуры на протекание
реакции изучали при содержании метана, равном 7.4×1017 молекул.
Температуру изменяли от 297 до 353 К. Полученные результаты представлены на
рис.3. Как видно, увеличение температуры реактора в указанных пределах приводит
к снижению расхода радикалов RO2 от 43 до 10%.
На основе этой температурной зависимости
оценка эффективной энергии активации дает значение -5±1 ккал/моль.Отрицательное
значение позволяет предположить, что реакция радикалов
CH3O2 с метаном идет через образование промежуточного
комплекса на поверхности реактора.
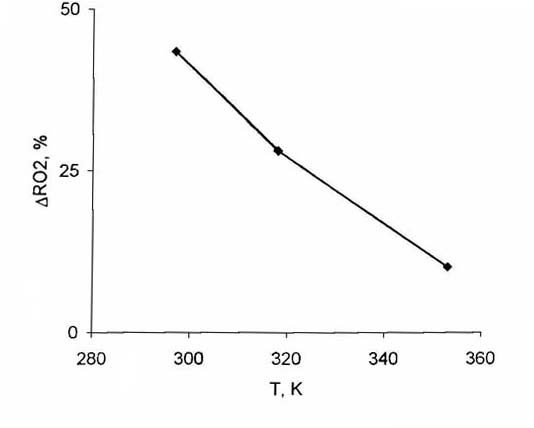
равной
5.6×1017 молекул.
2. Луспарян А. П.,
Оганесян Э. А., Варданян И. А., Налбандян А. Б. - Арм. хим.
журн.1985. Т. 38. С.33.
3. Бахчаджян Р.А., Варданян И. А., Налбандян А. Б. -
ДАН СССР. 1985. Т.26. С.611.
4. Keheyan E. H., Vardanyan I. A. - Арм. хим. журн.
1988. Т.51. С.177.
5. Налбандян
А. Б., Варданян И. А. Современное состояние проблемы
газофазного окисления органических соединений. Ереван. Изд-во АН АрмССР.
1986.
6. Phillips B., Starcher P.
S., Ash B. D. - J. Organic Chemistry. 1959. V.23.
P.1823.
7. Дорунц А. Г.,
Арустамян А. М., Баберцян Л. П., Оганесян Э. А., Варданян И.А., Налбандян А. Б.
- ДАН СССР. 1987. Т.292.
С.659.
8. Налбандян А. Б.,
Манташян А. А. Элементарные процессы в медленных газофазных
реакциях. Ереван. Изд-во АН АрмССР. 1975.
9. Tsang W., Hampsa
R. F., Chem. Kin. J.
Phys.
Chem. Ref. Data. 1986. V.15. P.1087.
10. Vardanyan I. A., Nalbandyan A. B. - IJCK. 1985.
V.17. P.901.
11. Nalbandyan A.
B., Oganessyan E. A., Grigoryan R. R., Garibyan T. A., Vardanyan I.A.
- Combust. and Flame. 1977. V.30.
P.177.
12. Семенов Н. Н.
О некоторых проблемах химической кинетики и реакционной
способности. М. Изд-во АН СССР. 1958.