УДК 616.631.11.547.96
А.Р.Варданян
Влияние аллоксана на физико-химические свойства
металлопротеинов крови in vitro
(Представлено академиком А.А. Галояном 13/III 2002)
Аллоксан в соответствующих дозах вызывает
гибель инсулинпродуцирующих b-клеток в островке
поджелудочной железы in vivo, что связывается с продуцированием во внеклеточной
среде и непосредственно в b-клетках супероксидных
радикалов (O2-) [1, 2]. Это
подтверждает и воздействие профилактически введенной Cu, Zn-супероксиддисмутазы
(СОД) при аллоксаниндуцированном диабете [3, 4]. Согласно свободнорадикальной
теории диабетогенеза в островке b-клеток поджелудочной
железы аллоксан восстанавливается до диалуриновой кислоты, и после его
автоокисления образуются O2- и
перекись водорода (как продукт ферментативного дисмутирования
O2-) [5]. Образующаяся
H2O2 по реакциям Габера-Вейса
(Fe+3+O2- ® Fe+2+O2) и Фентона
(H2O2+Fe+2 ®
HO·+HO-+Fe+3) является источником высокотоксичных
для различных биосистем гидроксильных радикалов (HO·). В частности, HO· нарушает синтез инсулина [6], выброс инсулина [7],
метаболизм глюкозы и потребление кислорода [8]. Целью работы является
определение факторов непосредственного воздействия аллоксана на
физико-химические свойства ключевых металлопротеинов - регуляторов метаболизма
активных форм кислорода крови in vitro, что позволяет расширить наши знания о
молекулярных механизмах воздействия аллоксана in vivo.
Металлопротеины крови антиоксидантного
действия: Cu,Zn-СОД, каталаза - из растворимой фракции эритроцитов,
церулоплазмин (ЦП) и трансферрин (ТФ) - из сыворотки крови и прооксидантного
действия: цитохромы b558I и b558II,
супероксидпродуцирующий липопротеин - супрол из сыворотки крови и цитохромы
b558III и b558IV - из мембран эритроцитов выделяли и
очищали методом М.А.Симоняна и сотр. [9] с определенными изменениями, в целях
исключения использования детергента как солюбилизирующего агента эритроцитарных
мембранных белков [10]. В частности, отдиализованные белковые фракции сыворотки,
эритроцитарных мембран и плазматической части эритроцитов подвергали
ионообменной хроматографии на отдельных колонках с целлюлозой DE-52 и KM-52
("Whatman", Англия) и сефадексом DEAE A-50 ("Pharmacia", Швеция) с дальнейшим
концентрированием на специальных фильтрах. В результате такой очистки получали
электрофоретически гомогенные и лиофилизованные препараты указанных
металлопротеинов. В опытах был использован препарат аллоксана фирмы "Sigma".
Количество полученных металлопротеинов определяли по величине плотностей
максимальных оптических поглощений, характерных для цитохромов
b558I-IV при 530 нм (a-полоса в окисленном состоянии гемопротеинов), супрола - 430
нм (слабое поглощение), ЦП - 610 нм, ТФ - 470 нм. Супероксиддисмутазную
активность фракций и супероксидпродуцирующую активность супрола определяли
методом нитротетразолиевого синего [11], рассчитав проценты ингибирования или
прироста образования формазана (при 560 нм) при восстановлении
нитротетразолиевого синего супероксидными радикалами в присутствии СОД или
супрола соответственно.
|
|
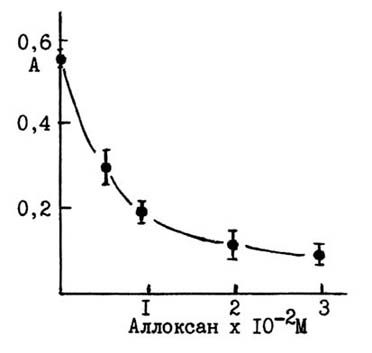
Рис.1. Интенсивность плотности максимального оптического
поглощения
формазана (560 нм) под воздействием аллоксана. Формазан образуется
при
восстановлении нитротетразолиевого синего супероксидными радикалами,
генерированными супролом (10-3 М) в присутствии аллоксана (время
инкубирования
60 мин при 20o, рH раствора 9.0).
Каталазную активность фракций устанавливли
перманганатометрическим методом, рассчитав количество расщепленной
H2O2 (М) определенным количеством фермента за 1 мин при
20o. Оптические спектры поглощения регистрировали на спектрофотометре
"Specord UV-VIS" (Германия) с длиной оптического пути 1 см. Опыт повторяли 4
раза для проверки воспроизводимости полученных результатов и для их
статистической обработки методом Стьюдента - Фишера.
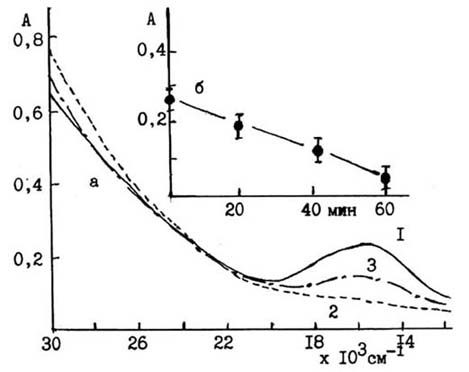
Рис.2. Воздействие аллоксана (2×10-2 М) на интенсивность плотности поглощения
ЦП (при 610
нм) при 20o (рH раствора 7.4): а - оптические спектры ЦП в отсутствии
аллоксана (1), после инкубирования в течение 2.5 ч (2). После аэрации или
удаления
аллоксана происходит реокисление меди в активном центре ЦП с
соответственным
повышением интенсивности плотности оптического поглощения при
610 нм (3); б -
кинетическая кривая падения интенсивности поглощения ЦП (при 610
нм) под
воздействием 2×10-2 М аллоксана (рH
раствора 7.4).
Аллоксан повреждает инсулинпродуцирующие b-клетки in vivo в островке поджелудочной железы в концентрациях 50-70 мг/кг веса животного, что для одной половозрелой крысы (массой 100 г) составляет около 2×10-2 М [3]. Поэтому для опытов in vitro был использован аллоксан, концентрация которого в реакционной смеси составляла 2×10-2 М. Во избежание изменения рH раствора в присутствии аллоксана (аллоксан имеет слабокислый характер) белки были растворены в 0,8М калий-фосфатном буфере (рH 7,4), буферная емкость которого практически не вызывала изменения рH раствора. Аллоксан (5×10-3 М) вызывал подавление на 50% супероксидпродуцирующей активности супрола, полученного из сыворотки плацентарной крови человека (рис.1). Полная инактивация этого супероксидпродуцирующего липопротеина нового типа происходила под воздействием 3×10-2 М аллоксана, после инкубирования аллоксана с супролом (10-3 М) в течение 60-70 мин при 20o. Такой дезактивирующий эффект аллоксана может быть связан с окислением NADPH группы супрола в аэробных условиях [12]. Видимо этот механизм реализуется и in vivo при аллоксановом диабете, при котором наблюдается падение O2--продуцирующей активности супрола с соответственным повышением его эндогенного уровня (это может быть связано с подавлением процесса расщепления супрола путем липидной пероксидации супероксидными радикалами). Под воздействием аллоксана (2×10-2 М) при 20o в течение часа происходит почти полное восстановление Cu(II) до Cu(I) в активном центре ЦП, что обусловливается прямолинейным падением интенсивности плотности характерного максимального оптического поглощения при 610 нм нативного ЦП (рис. 2 а, б). Это восстановление в 70±7,1% (P < 0,05) имеет обратимый характер (после аэрации кислородом или удаления аллоксана 30,2±4,1% (P < 0,01) ЦП остается в восстановленном состоянии и теряет свою нативность (рис.2, а, 3). В результате этого около 30% ЦП теряет свою ферроксидазную активность. Такой эффект наблюдается в опытах in vivo при аллоксановом диабете [13, 14].
|
|
Рис. 3. Изменение максимума оптического поглощения ТФ под
воздействием
2×10-2 М аллоксана, время
инкубирования 3 ч при 20o и рH 7.4: а - оптический
спектр поглощения
нативного ТФ (1) и после воздействия аллоксана (2); б -
кинетическая кривая
изменения максимального поглощения под воздействием
аллоксана в приведенных
условиях.
Аллоксан приводит к смещению характерного
максимального оптического поглощения ТФ от 470 нм к 485 нм (рис. 3), не изменяя
плотности поглощения in vitro в течение 3 ч при 20o. Это явление
носит необратимый характер и, видимо, действует на процесс связывания ионов
Fe(II), наблюдаемый при аллоксановом диабете [15]. Аллоксан подавляет
H2O2 расщепляющую активность каталазы на 20,2±3,3% (P < 0,05) в течение часа и практически не
дезактивирует Cu,Zn-СОД при 20o, что свидетельствует о связи
токсического влияния аллоксана с образованием и действием супероксидных
радикалов. Аллоксан в приведенных условиях практически не вызывает каких-либо
изменений форм и характерных максимумов поглощений оптических спектров как
сывороточных (цитохромы b558I и b558II), так и мембранных
эритроцитарных цитохромов b558III и b558IV [9]. Возможно
эти гемопротеины новых типов приспособлены к воздействиям
O2-, более того, они являются, в
основном, NADPH-зависимыми O2--продуцирующими системами.
Однако в экспериментах in vivo аллоксановый
диабет в основном, обостряется в течение не 2-3 ч, а 7-10 суток. За это время
защитно-адаптационные механизмы организма вырабатывают соответственный уровень
супрола, ЦП, ТФ и каталазы, несколько увеличивая их. Это компенсирует понижение
ферроксидазной активности ЦП, Fe-связывающей активности ТФ [13] и активности
каталазы. Cu,Zn-СОД активность в крови при аллоксановом диабете снижается in
vivo и не изменяется под воздействием аллоксана in vitro, что свидетельствует о
повышенном расходовании СОД в процессе дисмутирования повышенных концентраций
супероксидных радикалов. Напомним, что O2-, наряду с H2O2 (последние
являются продуктом ферментативного дисмутирования O2-), способны инактивировать Cu,Zn-СOД [16]. Можно
констатировать, что механизмы воздействия аллоксана in vivo и in vitro несколько
совпадают и связаны не только с нарушением функции инсулининдуцирующих b-клеток островков поджелудочной железы in vivo, но и с
непосредственным нарушением функций некоторых ключевых металлопротеинов (супрол,
ЦП, ТФ, каталаза) в эксперименте.
Институт биохимии им. Г.Х. Бунятяна
НАН РА
Медицинский колледж им М.Гераци,
Гюмри
Литература
1. Grankvist K., Marklund S.
- FEBS Lett. 1979. V.105. P.
15-18.
2. Fischer L.J.
- Diabetes. 1980. V. 29. P.
213-216.
3. Grankvist K.,
Marklund S. - Nature. 1981. V. 294. P.
158-160.
4. Симонян М.А.,
Геворкян Д.М., Мхитарян В.Г. - Бюлл. эксп. биол. мед. 1987.
Т. СIII. С. 306-308.
5. Heikkila
R.E., Winston B., Cohen G., Barden H. - Biochem. Pharmac.
1976. V. 25. P. 1085-1092.
6. Gunnarsson R. - Molec. Pharmac. 1975. V. 11. P.
759-765.
7. Lacy P.E., Lernmark
A., Sehlin J., Taljedal I.B. - Biochem.J. 1977. V. 162. P.
9-18.
8. Borg H., Eide S.J.,
Anderson A., Hellerstrom C. - Biochem.J. 1979. V. 182. P.
797-802.
9. Симонян М.А., Симонян
Г.М., Мелконян Р.В. - Пром. собств. (Офиц. бюлл.
Армпатента). Ереван. 1997. С.34.
10. Симонян М.А., Симонян Г.М., Григорян Г.Г., Симонян Р.М. - Лицензия изобр. N 908. Армпатент. 2001.
Ереван.
11. Nishikimi M., Rao
N.A., Jagik K. - Biochem. Biophys. Res. Comm. 1972. V. 46.
P. 849-856.
12. Симонян М.А.,
Карапетян А.В., Бабаян М.А., Симонян Р.М. - Биохимия. 1996.
Т.61. С.932-937.
13. Варданян
А.Р., Геворкян Д.М., Агаджанов М.И., Симонян М.А. - Мед.
наука Армении. 1999. Т. 39. С.38-42.
14. Мжельская Т.И.
- Бюлл. эксп. биол. мед. 2000. Т.130.
С.124-133.
15. Fujii H., Johonson
M.K., Finnegan M.G. et.al. - J. Biol. Chem. 1995. V. 270. P.
12685-12694.
16. Fridovich I.
- Annu. Rev. Biochem. 1995. V. 64. P. 97-112.