УДК 612.826+612.812.89
Электрофизиологическое исследование влияния медиального ядра
септума на активность бульбарных дыхательных
нейронов и симпатических
нервов
(Представлено академиком В. В. Фанарджяном 16/IV 2002)
Прозрачная перегородка (septum pellucidum)
является важной подкорковой структурой лимбической системы, тесно связанной не
только с гипоталамусом и амигдалой, но и с гиппокампом, базальными ганглиями,
лимбической корой, таламусом, структурами среднего и продолговатого мозга [1-7].
В ней отчетливо выделяются вентральная, латеральная и медиальная ядерные
структуры [8]. Медиальное ядро (MSN) занимает центральное место в септуме и в
вентральном направлении переходит в ядро диагонального пучка. Имеющиеся в
литературе малочисленные данные [9-16] о роли септальных структур в центральных
механизмах регуляции кардиоваскулярной и дыхательной функций довольно
противоречивы и касаются в основном параметров внешнего дыхания. Однако по
изменению внешнего дыхания нельзя судить о функциональном состоянии различных
групп респираторных нейронов и, следовательно, выявить нейронные механизмы
регуляции активности бульбарного дыхательного центра септальными структурами
лимбического мозга. Исходя из вышеизложенного, в настоящей работе с целью
исследования септальных механизмов регуляции дыхательной и кардиоваскулярной
функций изучены характер и особенности влияния MSN перегородки на активность
функционально идентифицированных бульбарных дыхательных нейронов и
постганглионарных симпатических нервов - нижнего сердечного и позвоночного,
иннервирующих соответственно коронарные и соматические
сосуды.
Эксперименты выполнены на взрослых
кошках, наркотизированных смесью хлоралозы и нембутала (45 и 5-10 мг/кг
соответственно, внутрибрюшинно). Голову животного жестко фиксировали в
стереотаксическом приборе, с дорсальной стороны обнажали продолговатый мозг и
исследовали область вентрального дыхательного ядра бульбарного дыхательного
центра, где локализованы и инспираторные, и экспираторные нейроны. Импульсную
активность одиночных дыхательных нейронов отводили экстраклеточно стеклянными
микроэлектродами, заполненными 2 М раствором цитрата калия или 3 М раствором
хлористого натрия (диаметр кончика 1-2 мкм). Потенциалы действия нейронов через
катодный повторитель подавали на вход усилителя переменного тока японской
установки "Nihon Kohden" и регистрировали на одном из каналов двухлучевого
осциллографа. Для функциональной идентификации исследуемых дыхательных нейронов
одновременно на втором канале осциллографа регистрировали внешнее дыхание
животного при помощи угольного датчика, подключенного через мостовую схему, и
усилителя постоянного тока. Параллельно с осциллографической регистрацией
импульсную активность тестируемого нейрона обрабатывали на анализаторе NTA-1024
(Венгрия) и записывали двухкоординатным самописцем в виде гистограмм частотного
распределения импульсов в дыхательных залпах. В зависимости от разрядной
активности нейрона временной интервал, в котором отсчитывалось количество
импульсов, подбирался равным 200 или 500 мс (шаг
анализа).
Для отведения тонической активности
постганглионарных симпатических нервов удаляли I и II ребра с левой стороны
грудной клетки вблизи позвоночника, экстраплеврально вскрывали звездчатый
ганглий и отпрепаровывали нижнесердечную и позвоночную ветви. Концы перерезанных
нервов помещали на биполярные серебряные отводящие электроды. Биопотенциалы
нервов записывали на многоканальном электроэнцефалографе и одновременно при
помощи электронного интегратора вели запись интегрированных потенциалов с шагом
анализа 2.5 с. Частотное (50-100 Гц) раздражение MSN перегородки осуществляли
через стереотаксически введенные биполярные константановые электроды (диаметр
кончиков 40-50 мкм) с межполюсным расстоянием 0.5-0.8 мм. Стимуляцию производили
прямоугольными толчками тока длительностью 0.3-0.5 мс и интенсивностью, равной
пороговым значениям. Для контрольного измерения системного артериального
давления вскрывали и канюлировали бедренную артерию. В конце опыта раздражаемую
структуру электролитически разрушали и производили гистологический контроль.
Полученные экспериментальные данные статистически
обработаны.
В первой серии экспериментов
исследованы реакции 226 нейронов вентрального дыхательного ядра продолговатого
мозга (132 инспираторных, 94 экспираторных) на электрическую стимуляцию MSN
перегородки. Изменения в характере импульсной активности дыхательных нейронов и
дыхания животного при стимуляции MSN имели более низкий порог, чем сдвиги
исходного уровня артериального давления, поэтому учитывались лишь те реакции,
которые наблюдались сразу после нанесения порогового для дыхания раздражения, и
не учитывались вторичные изменения, которые могли возникнуть в результате
изменения гемодинамики. Эффекты считались истинными только при их обратимости и
воспроизводимости.
Реактивными на раздражение
MSN оказались 76.5% бульбарных дыхательных нейронов. От общего количества
реактивных нейронов (173-101 инспираторных, 72 экспираторных) 56% дыхательных
нейронов (97-57 инспираторных, 40 экспираторных) отвечали подавляющим типом
реакций. При подавляющих реакциях наблюдалось статистически достоверное
уменьшение средней частоты импульсов в инспираторных залпах на 57.2±5.6%, в экспираторных - на 54.3±6.2% и удлинение межзалповых интервалов, т.е. уменьшение
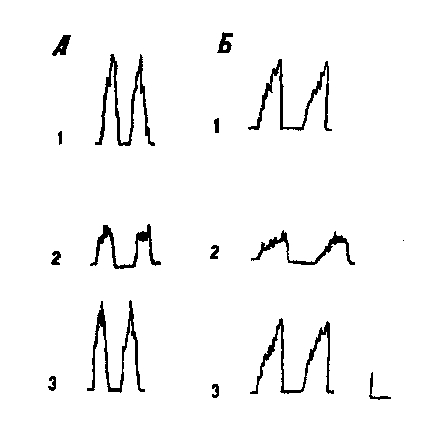
скорости возникновения дыхательных залпов. Пример подавляющих реакций
инспираторного и экспираторного нейронов, наблюдаемых при стимуляции MSN,
показан на рис. 1, где на представленных гистограммах отчетливо видно угнетение
средней частоты импульсов в дыхательных залпах и увеличение межзалповых
интервалов. Остальные 44% реактивных дыхательных нейронов на раздражение MSN
отвечали возбудительным типом реакций, что выражалось в статистически
достоверном увеличении средней частоты импульсов в инспираторных залпах на
53.2±4.3%, в экспираторных - на 51.4±5.6% и укорочении межзалповых интервалов, т.е. в увеличении
скорости возникновения дыхательных залпов. Как при уменьшении, так и при
увеличении средней частоты импульсов в дыхательных залпах под влиянием
стимуляции MSN могли меняться длительность залпов и количество импульсов в них
без изменения характера распределения межимпульсных интервалов в залпе. Этот
инвариантный показатель сохранялся стабильным, пока дыхание животного оставалось
ритмичным.
Сравнение пороговых интенсивностей
раздражения, вызывающих реакции инспираторных и экспираторных нейронов,
показало, что порог для инспираторных единиц (особенно раннеинспираторных) более
низкий, чем для экспираторных.
Описанные
изменения в характере залповой активности тестируемых дыхательных нейронов под
влиянием стимуляции MSN перегородки сопровождались соответствующими изменениями
дыхания животного. Так, уменьшение скорости возникновения дыхательных залпов и
средней частоты импульсов в них сопровождалось урежением дыхания, тогда как при
изменении этих параметров в сторону увеличения, напротив, наблюдалось учащение
дыхания.
|
|
Во второй серии
экспериментов исследовано влияние стимуляции MSN на тоническую активность
нижнесердечного и позвоночного нервов, иннервирующих соответственно регионарные
(коронарные) и соматические сосуды. Сравнительное исследование амплитудной
характеристики биопотенциалов этих нервов показало, что амплитуда фоновой
интегрированной активности нижнего сердечного нерва составляет в среднем
5.57±0.37 мкВ/с, а позвоночного - 4.9±0.35 мкВ/с. Анализ полученных данных показал, что при
раздражении MSN перегородки наблюдалось однонаправленное статистически
достоверное как угнетение, так и усиление интегрированной активности
нижнесердечного и позвоночного нервов с преобладанием подавляющих влияний (57%).
На рис. 2 представлено однонаправленное подавляющее действие стимуляции MSN на
биопотенциалы и интегрированную активность нижнесердечного (рис. 2, 2,3)
и позвоночного (рис. 2, 4,5) нервов.
Таким образом, результаты проведенных исследований свидетельствуют о
том, что MSN перегородки оказывают выраженное модулирующее (как подавляющее, так
и облегчающее) влияние на активность бульбарных дыхательных нейронов и
симпатических нервов, обеспечивающих нейрогенный тонус коронарных и соматических
сосудов, с преобладанием подавляющих влияний.
|
|
Подавляющее и облегчающее влияние септума может реализоваться как через
септоамигдалогипоталамические проводящие пути, так и через систему прямых
септобульбарных путей, обнаруженных в морфологических исследованиях, благодаря
применению ауторадиографических и гистохимических методов исследования [4,5].
Наличие прямых септобульбарных связей указывает на возможность и
непосредственной септо-фугальной модуляции активности вегетативных центров
продолговатого мозга без релейных переключений в структурах гипоталамуса и
ростральных отделах ствола мозга.
Итак,
выявленные в настоящей работе изменения активности бульбарных дыхательных
нейронов и изученных симпатических нервов, наблюдаемые при стимуляции MSN
перегородки, являются, вероятно, компонентами сложных интегрированных реакций, и
поэтому мы полагаем, что исследованные нами септальные нейроны - это
полиэффекторные нейроны интегративного типа, запускающие дыхательные,
кардиоваскулярные и другие вегетативные и соматические проявления
эмоционально-мотивационных реакций организма.
Институт физиологии НАН РА им. Л. А. Орбели
1. Баклаваджян О. Г. Нейронная организация амигдало-висцеральной рефлекторной дуги. Донецк.
Дон. ГМУ. 1996. 117 с.
2. Ивнев Б. Б. Связи перегородки с лимбическими структурами
головного мозга. Автореф. канд. дис. 1991. Донецк. 17
с.
3. Коваль И. Н., Саркисов Г.
Т., Гамбарян Л. С. Септо-гиппокампальная система и организация
поведения. Ереван. Изд-во АН АрмССР. 1986. 126 с.
4. Holstege G., Meiners L., Tan K.- Exp.
Brain Res. 1978. N4. P. 529-547.
5. Iansen S. A., Ciriello G. - Soc. Neurosci. Abst. 1991. V.
17. P. 706.
6. Martin L. J.,
Powers R. E., Dellovade T. L., Price L. D. - Comp. Neurol. 1991.
V. 309. N4. P. 445-485.
7. Mizuno N., Takahashi O., Satoda T., Natsushima R. - Neuroscience Letters. 1985. V. 53. N3. P.
327-330.
8. Isaacson R. L. The limbic system. N. Y. London. Plenum Press. 1976.
296p.
9. Calaresu F. R.,
Ciriello J., Mogenson G. J.- J.Physiol (London). 1976. V. 260. P.
515-530.
10. Calaresu F. R.,
Mogenson G. J. - Amer. J. Physiol. 1972. V. 223. P.
777-782.
11. Covian M. R.,
Antunes-Rodriquer J., O’Flaherty J.- J. Neurophysiol. 1964. V. 27.
P. 394-407.
12. Gelsema A. J.,
Calaresu F. R. - Amer. J. Physiol. 1987. V. 252. P.
760-767.
13. Giancola S. B.,
Rodes S., Ciriello J.- Brain Res. 1993. V. 606. N1. P.
162-166.
14. Henke P.G. - A review. Neurosci. Hiobehav. Rev. 1982. V. 6. P.
381-390.
15. Holdstock T. L.- Psychonomic Sci. 1967. N9. P.37-38.
16.
Loewy A. D.- Prog. Brain Res. 1991. V.
87. P. 253-268.