МОЛЕКУЛЯРНАЯ БИОЛОГИЯ
УДК 577.125
А.З. Пепоян, Н.С. Мирзоян, М.О. Саакян, Л.А. Киракосян,
академик К.Г. Карагезян
Некоторые особенности антиокислительной системы
бактериальных
штаммов Escherichia coli G35
(Представлено 10/IV 2001)
О ведущей роли реакций свободнорадикального
окисления липидов биологических мембран, называемых также реакциями перекисного
окисления липидов (ПОЛ), первоначально говорилось в связи с двумя
патологическими состояниями: лучевой болезнью и злокачественным ростом. В
последующие годы список патологий, в патогенезе которых предполагали вовлечение
активности процессов ПОЛ, существенно расширен [1,2]. Вывод об участии процессов
ПОЛ в возникновении и развитии разных патологических состояний организма был
сделан на основе способности ингибиторов свободнорадикального окисления
различной химической природы в той или иной мере предупреждать или ограничивать
повреждения, характерные для данных патологий.
Ранее нами было показано, что штаммы E.coli
G35 N49 и E.coli G35 N61 из кишечной микрофлоры человека [3] отличаются
некоторыми физико-химическими параметрами мембран клеток, включая также
качественный и количественный состав фосфолипидов (ФЛ) этих клеток и др.
Целью настоящей работы явилось изучение
процессов ПОЛ, пероксидазной и каталазной активности бактериальных штаммов
E.coli G35 N49 и E.coli G35 N61.
Об активности ПОЛ судили по содержанию
малонового диальдегида (МДА), образующего реакцию окрашивания с тиобарбитуровой
кислотой, интенсивность которого регистрировали спектрофотометром СФ-4А при
длине волны 535 нм. Количество перекисей пересчитывали на 1 мл фосфора данной
суспензии. Количество фосфора определялось при изучении ФЛ состава клеток [4].
Для определения интенсивности ПОЛ в клеточных
жидкостях после роста штаммов E.coli в стационарной фазе роста в питательном
бульоне клетки удалялись из бульона и измерялась активность ПОЛ как в клеточной
суспензии и клеточном экстракте, так и в 0.2 мл объеме бульона.
Известно, что фермент НАД.Н-цитрохром
С-редуктаза является начальным звеном перекисного окисления ненасыщенных жирных
кислот, поэтому количество МДА нами определялось как в аскорбат-зависимой
системе, так и в НАДФ.Х-зависимой системе переокисления.
Пероксидазную активность определяли по методу
[5]. В качестве окисляемого субстрата использовался пирогаллол, который
окислялся в пурпурогалин с максимумом поглощения 430 нм. Измерения оптической
плотности проводили на спектрофотометре СФ-46.
Исследуемый раствор содержал 0.8 мл 0.006 М
натрий-фосфатного буфера pH-6,8; 0.12 мл ферментной вытяжки (суспензия, экстракт
или культуральная жидкость); 0.5 мл 0.15%-ной H2O2; 1.1 мл
H2O и 0.5 мл 0.003 М пирогаллола. В контроле вместо
H2O2 добавляли 0.5 мл H2O.
Активность фермента определяли по следующей
формуле:
| A = Dt2 - Dt1 / (t2 - t1)c, | |
где
A - активность фермента, D - оптическая плотность, t - время (с), c -
концентрация. Измерения проводили в течение 2.5-3 мин.
Каталазную активность бактериальных штаммов
E.coli G35 определяли по методу [6], основаному на том, что две молекулы
H2O2 разлагаются на 2H2O + O2. Избыток
перекиси титруют перманганатом в кислой среде. В опыте определяли количество
оставшейся неразрушенной перекиси водорода, а в контроле - общее количество
взятой H2O2 в присутствии каталазы, инактивированной
кипячением. Вычитывая результаты опыта из результатов контроля, определяли
количество разрушенной за определенное время (30 мин) перекиси, что дает
возможность судить об активности каталазы.
Для проверки полученных данных был
использован статистический метод Стюарта - Фишера. В обеих НАДФ.Н- и
аскорбат-зависимых системах переокисления исследуемые штаммы E.coli G35,
преобладающие как в кишечной микрофлоре здоровых людей (E.coli G35 N61), так и в
кишечнике больных раком (E.coli G35 N49), показали одинаковую интенсивность ПОЛ.
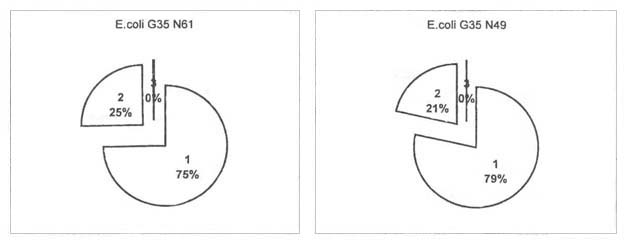
В табл. 1 представлен процесс ПОЛ НАДФ.Н-зависимой системы переокисления
клеток E.coli G35. Данные таблицы свидетельствуют также о наличии интенсивности
ПОЛ как в клеточной суспензии и клеточном экстракте, так и в культуральных
жидкостях обоих типов E.coli G35. При этом, однако, выявлено, что если уровень
ПОЛ в исследуемых клетках E.coli в клеточных экстрактах одинаков, то он
различается в клеточных суспензиях и культуральных жидкостях.
Сохранение одинаковой активности ПОЛ в
клеточных экстрактах штаммов E.coli, по-видимому, способствует поддержанию
определенного метаболического статуса обоих типов исследуемых клеток E.coli, в
то время как изменения уровня процессов ПОЛ в клеточных суспензиях и
культуральных жидкостях может влиять на формирование патологических состояний
больных раком людей.
Таблица 1
Процесс перекисного окисления липидов клеток Escherichia
coli G35
|
Бактериальные
штаммы |
Количество малонового диальдегида на 1 мг
фосфора |
|
Клеточная суспензия |
Клеточный
экстракт |
Культуральная жидкость* |
| E.coli G35 N61 |
121.3±2.4 |
40.72±1.05 |
0.625±0.08 |
| E.coli G35 N49 |
150.74±1.75 |
40.65±2.21 |
0.171±0.06 |
*Абсолютные показатели количества МДА по СФ
без пересчета на 1 мг фосфора.
|
|
Окисление липидов мембран, как доказано
многочисленными экспериментами, подчиняется законам жидкофазного окисления
органических веществ. Среди ФЛ при пероксидации больше всего разрушаются
фосфатидилэтаноламины и фосфатидилхолины, что несомненно отражается на конечной
концентрации этих ФЛ в мембранах исследуемых штаммов E.coli [7].
Как известно, пероксидазы являются
антиоксидантыми ферментами, одной из основных функций которых является
разрушение опасных для жизнедеятельности клеток пероксидов. Результаты по
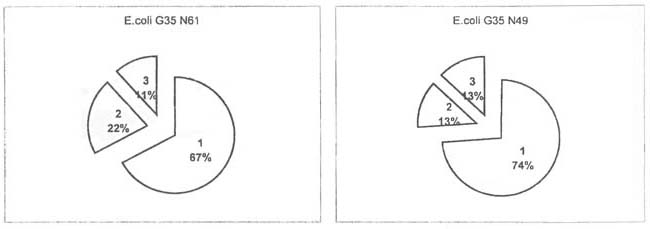
изучению пероксидазной активности штаммов E.coli приведены в табл. 2, из
которой явствует, что изученные штаммы отличаются также пероксидазной
активностью. Показано, что в клеточных суспензиях как у E.coli G35 N61, так и у
E.coli G35 N49 наблюдается максимальная активность фермента (соответственно
0.233×10-3±0.01 и
0.169×10-3±0.01 с-1мг-1). Установлено также
существенное различие уровня пероксидазной активности штаммов E.coli G35 N61 и
E.coli G35 N49 в клеточных экстрактах (соответственно 0.075×10-3±0.01 и 0.030×10-3с-1мг-1).
Таблица 2
Пероксидазная активность клеток Escherichia coli
|
Бактериальные
штаммы |
Уровень пероксидазной активности (с-1мг-1) |
|
Клеточная суспензия |
Клеточный
экстракт |
Культуральная жидкость |
| E.coli G35 N61 |
0.233×10-3±0.01 |
0.075×10-3±0.01 |
0.04×10-3±0.01 |
| E.coli G35 N49 |
0.169×10-3±0.01 |
0.03×10-3 |
0.03×10-3±0.01 |
|
|
Каталазная активность у штаммов E.coli
отсутствует, что характерно для бактериальных клеток E.coli [8].
По литературным данным, изменения состояния
ПОЛ и активности ряда ферментов антиокислительной системы влияют на вязкость
мембран, и в связи с этим изменяется и проницаемость мембраны бактериальных
клеток. Процесс повреждения мембран может сопровождаться выходом некоторых
ферментов в надосадочную жидкость, что, в свою очередь, может быть причиной
интенсификации процессов ПОЛ в культуральных жидкостях штаммов E.coli G35 [8].
Все вышеупомянутое свидетельствует о различии
процессов ПОЛ и пероксидазной активности штаммов E.coli G35, что может иметь
влияние как на смену и сборку мембранных белков и регуляцию активности отдельных
мембранных протеинов, так и на общий метаболический статус организма.
Таким образом, установлено, что клеточные
стенки и цитоплазматические мембраны E.coli G35, характерные для здоровых и
больных раком людей, значительно отличаются как по ФЛ составу, так и по
некоторым особенностям антиокислительной системы.
Институт молекулярной биологии НАН РА
Литература
1. Козлов Ю.П., Качан В.Е.
Молекулярные механизмы повреждения кислородом системы
транспорта кальция в саркоплазматическом ретикулуме мышц. Иркутск. 1983.
2. Wendel A., Reiter R.
Oxygen Radicals in Chemistry and Biology. Proc. Int. Conf.
3-rd. Eds. W.Bras, M.Saran, Traid D. Berlin. 1984. P.
345-349.
3. Карапетян А.О.
Биологический антагонизм некоторых представителей кишечной
микрофлоры и опухолевых клеток. Автореф. канд. дис. М. 1987.
4. Саакян М.О, Пепоян А.З.,
Киракосян Л.А., Епископосян А.Р., Карапетян А.О., Шагинян А.А., Карагезян К.Г.
- ДНАН Армении. 1999. Т.99. N 4. С. 362-366.
5. Кушманова О.Д., Иванченко
Г.М. Руководство к лабораторным занятиям по биологической
химии. М. Медицина. 1983.
6. Асатиани В.С. - Ферментные методы анализа. М. 1969.
С. 611-612.
7. Pepoyan A.Z.,
Kirakossyan L.N., Shahinian A.A., Karageuzian K.G. - HABSI.
ISFOS. 1999. Japan.
8. Берги.
Краткий определитель бактерий. Под ред. Хоуста Дж. М. Мир.
1980.

