БИОХИМИЯ
УДК 577.125:577.151
Академик М. А. Давтян, Л. А. Навасардян, С. В. Марутян, А.
З. Пепоян
Некоторые особенности выживаемости дрожжей Candida
guilliermondii НП-4
(Представлено 5/V 2001)
Самыми характерными проявлениями общей
реакции дрожжевых клеток на облучение являются нарушения клеточного деления,
атипичные клеточные формы и колонии. В многочисленных исследованиях показано,
что при облучении достаточно высокими дозами клетки, теряя способность к
делению, остаются жизнеспособными с физиологической точки зрения и обладают
способностью синтеза общих клеточных компонентов [1], однако имеется и другая
точка зрения.
Целью настоящего исследования являлось выявление
особенностей выживаемости дрожжей Candida guilliermondii НП-4 при их облучении
рентгеновскими лучами.
Дрожжевые клетки выращивались на 2%-ном сусло-агаре, затем
в жидкой питательной среде [2] и были подвергнуты облучению на рентгеновской
установке Дрон-3 в интервале доз 0.86 ё108кР при l = 0.71A.
Выживаемость дрожжей регистрировалась после 24-часовой
инкубации при 300C. Количество биомассы определялось
колориметрическим путем (ФЭК КФК-2МП, l = 590 нм).
Сравнительное исследование динамики роста и
колониеобразования дрожжей, облученных 54 кР дозой (U = 35 кВ, I = 15 мА, время
экспозиции-30 мин), проводилось в течение первых 24 ч пострадиационной
инкубации. Кинетические параметры роста определялись путем ежечасного измерения
оптической плотности культуральной жидкости облученных и необлученных дрожжей.
Количество выживших дрожжевых клеток определялось путем титрования на чашках
Петри со средой 2%-ного сусло-агара. Был учтен также эффект "дорастания".
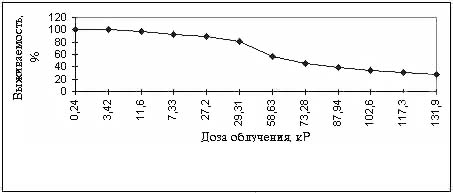
Рис.1. Зависимость выживаемости дрожжей C.guilliermondii НП-4 от дозы
облучения
Как свидетельствуют данные (рис.1), дрожжевые клетки
C.guilliermondii НП-4 характеризуются сигмоидной кривой выживаемости. Этот факт
можно обьяснить тем обстоятельством, что клеточная популяция гетерогенна по
радиочувствительности и распределение признака радиочувствительности в популяции
близко к нормальному. Однако такое объяснение больше применимо для кривых
смертности млекопитающих.
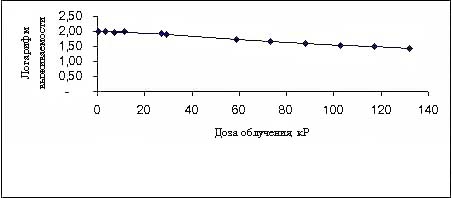
Рис.2. Зависимость выживаемости дрожжей C.guilliermondii НП-4 от дозы
облучения (полулог. масштаб)
Известно, что для большинства грибов кривая зависимости
выживаемости от дозы облучения имеет сигмоидную форму. Для некоторых дрожжей
наблюдаются одноударные кривые выживаемости, поэтому сделано предположение, что
наличие у других видов дрожжей сигмоидных кривых выживаемости является
свидетельством того, что эти клетки или многоядерные, или полиплоидны, причем
каждое ядро или каждый геном повреждается одним ударом. Для таких клеток
экстраполяционное число совпадает с количеством ударов, однако не совпадает с
плоидностью, хотя с увеличением плоидности оно закономерно растет. Этот факт
говорит о том, что при облучении полиплоидных клеток происходит не повреждение
разных геномов как единиц, а, по-видимому, имеют место доминантные летали [1]
или идентичные летальные повреждения [3].
Расчеты полученных нами данных и их графический анализ
(рис.2) показали, что экстраполяционное число для дрожжей C.guilliermondii НП-4,
подвергнутых рентгеновскому облучению, составляет n = 2. Таким образом, можно
утверждать, что исследованные дрожжевые клетки являются двухядерными.
Сигмоидные кривые выживаемости наблюдаются также в
случаях, когда клетки не обладают многими чувствительными участками, а действует
механизм восстановления повреждений, возникших под влиянием облучения.
Анализ кривой выживаемости дрожжей C.guilliermondii НП-4
показал, что ЛД50 для этих клеток составляет 72 кР. Из литературных
данных известно, что ЛД50 для близкородственных им дрожжей
S.cerevisiae составляет 30кР. Полученные нами данные свидетельствуют (табл.1),
что дрожжевые клетки C.guilliermondii НП-4 примерно в 2.5 раза радиостабильнее
по отношению к клеткам S.cerevisiae. Такую высокую радиостабильность можно
объяснить наличием в ядрах клеток довольно эффективного механизма восстановления
молекулы ДНК, а также наличием у клеток рода Candida довольно прочной клеточной
стенки, состоящей из белково-углеводного комплекса, экранированием рентгеновских
лучей, особенностями радикал-тушителей.
Таблица 1
Кинетические параметры роста дрожжей C.guilliermondii НП-4
| Фазы роста |
Облучение клетки |
Необлученные клетки |
|
m |
t1 |
m |
t1 |
| Ранняя логарифмическая фаза |
0.23±0.03 |
3 |
0.39±0.03 |
1.78 |
| Поздняя логарифмическая фаза |
0.37±0.03 |
1.87 |
0.55±0.03 |
1.26 |
Примечания. - m - удельная скорость
роста клеток; t1 - время удвоения клеток, ч.
Возможно также, что радиозащитную
роль играют гистоновые белки, сами являющиеся тушителями свободных радикалов.
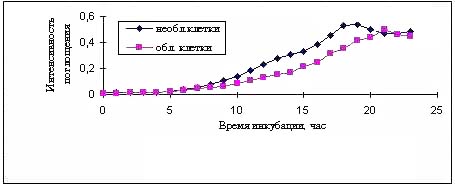
Как видно из рис.3, протяженность lag- фазы роста
облученных дрожжей составляет 8 ч, что на 2 ч дольше по сравнению с
необлученными клетками. В конце lag-фазы, адаптируясь к условиям среды, как
необлученные, так и облученные клетки начинают интенсивно делиться и фактически
переходят к логарифмической (log) фазе роста. Протяженность log-фазы как у
облученных, так и необлученных дрожжей составляет примерно 12 ч, но начало
log-фазы у облученных дрожжей задерживается на 2 ч по сравнению с
необлученными клетками. Такую задержку можно объяснить генетическими сдвигами в
облученных клетках, вследствие которых нарушается клеточный цикл, в частности
задерживается фаза митоза. В результате этого наблюдается падение митотической
активности. Причиной задержки митоза может быть задержка перехода клеток к
G2 фазе клеточного цикла, или, как она называется в литературе, блок
G2. Этот блок характеризуется тем, что облученные клетки переходят к
профазе с нормальной скоростью и накапливаются в этой фазе: дальнейшее деление
клетки задерживается.
|
|
Рис.3. Динамика роста дрожжей C.guilliermondii НП-4
Причиной задержки могут быть также хромосомные аберрации, возникающие в
клетках под влиянием облучения; деспирализация хромосом и превращение их в
интерфазные, вследствие чего клетки из профазы "возвращаются" к интерфазе;
нарушения синтеза белков, участвующих в митозе, особенно в синтезе центриолов
[4].
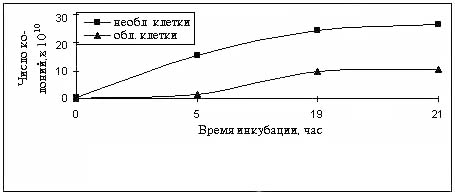
Рис.4. Способность колоннеобразования дрожжей C.guilliermondii НП-4
В течение первых нескольких часов после облучения,
благодаря работе репарационной системы клетки, восстанавливается часть
повреждений, и клеточная популяция переходит в log-фазу роста.
Стационарная фаза роста у облученных дрожжей
устанавливается опять с 2-часовой задержкой, хотя с приближением к стационарной
фазе роста различия в количествах биомассы между облученными и необлученными
клетками практически исчезают.
С целью сравнительного исследования кинетических
параметров роста дрожжевых клеток определен коэффициент удельного роста (m) в разных фазах пострадиационной инкубации (табл.1). Как
свидетельствуют полученные данные, коэффициент удельного роста в ранней log-фазе
составляет 0.39±0.03 для необлученных и 0.23±0.03 для облученных клеток. В поздней log-фазе коэффициент
m приобретает значения 0.55±0.02 и 0.37±0.03 соответственно для
необлученных и облученных клеток. Таким образом, как в ранней, так и поздней
log-фазах коэффиецент удельного роста для облученных дрожжей меньше по сравнению
с необлученными клетками, причем разность почти одинакова - Dm = 0.16 и 0.18 соответственно.
Определены также значения времени удвоения биомассы в разных фазах роста. Для
необлученных клеток в ранней log-фазе оно составляет 1.78 ч, а в поздней - 1.26
ч. Облученные клетки по этому параметру также уступают необлученным клеткам: в
ранней log-фазе время удвоения составляет 3 ч, а в поздней - 1.87 ч.
Таблица 2
Выживаемость дрожжей C.guilliermondii НП-4 в разных фазах
пострадиационного роста
| Фазы роста |
Облучение клетки |
Необлученные клетки |
|
Число колоний |
Показания ФЭК |
Число колоний |
Показания ФЭК |
| Начальная точка |
0.6×10 |
0.017 |
0.4×10 |
0.021 |
| Ранняя логарифмическая фаза |
0.4×10 |
0.021 |
0.13×10 |
0.026 |
| Поздняя логарифмическая фаза |
0.10×10 |
0.039 |
0.27×10 |
0.041 |
| Стационарная фаза |
0.10×10 |
0.040 |
0.28×10 |
0.042 |
Примечания. - показания ФЭК сняты после разбавления раствора в
1010 раз
Данные,
полученные при исследовании темпов колониеобразования у дрожжей C.guilliermondii
НП-4 (рис.4), подтверждают результаты исследования динамики роста необлученных и
облученных клеток. Как видно из графика, в случае облученных клеток имеет место
падение темпов роста по сравнению с необлученными. Соответствующие
количественные данные, приведенные в табл.2, свидетельствуют, что во всех фазах
пострадиационной инкубации наблюдаются различия в темпах роста необлученных и
облученных дрожжей. Так, для необлученных клеток в ранней log-фазе наблюдается
увеличение числа колоний примерно в 300 раз, а для облученных клеток - всего в 7
раз. В поздней log-фазе для необлученных клеток наблюдается удвоение числа
колоний, а в случае облученных клеток число колоний увеличивается примерно в 25
раз. В стационарной фазе роста не наблюдается значительного изменения числа
колоний в обоих вариантах клеток. Таким образом, по сравнению с начальной точкой
в стационарной фазе роста имеет место увеличение числа колоний примерно в 700
раз для необлученных и в 170 раз для облученных клеток.
Обобщая полученные нами данные по колониеобразованию,
можно предположить, что у необлученных дрожжей интенсивный рост наблюдается в
ранней log-фазе роста. Для облученных клеток в этой фазе наблюдается падение
темпов роста, а более интенсивный рост наблюдается в поздней log-фазе. Эти
данные подтверждают наблюдаемую нами в динамике роста облученных дрожжей картину
2-часовой задержки log и стационарной фаз. Одновременно из данных табл.2
явствует, что темпы накопления биомассы вместе с ростом числа колоний
закономерно увеличиваются (примерно в 3 раза). Однако в стационарной фазе роста
не наблюдается значительных различий в отношении количества биомассы
необлученных и облученных дрожжей. Это можно объяснить наличием небольшого
количества бурно растущих клеток или образованием гигантских клеток в популяции
облученных дрожжей.
Таким образом, исследования по выживаемости дрожжевых
клеток рода Candida, подвергнутых рентгеновскому облучению, показали, что у
дрожжей C.guilliermondii НП-4 под влиянием рентгеновского облучения наблюдается
падение выживаемости по сигмоидной кривой, что не характерно для низших
эукариот. Одной из причин этого может быть принадлежность исследованных дрожжей
к числу многоядерных организмов. Предполагается, что под влиянием рентгеновского
облучения в ДНК происходят однонитевые разрывы, которые в процессе
пострадиационной инкубации превращаются в двунитевые разрывы вследствие так
называемой "неправильной репарации" [5]. Участок падения на кривых выживаемости
соответствует периоду максимального проявления разрывов, когда выживаемость
клеток должна быть наименьшая. Дальнейшая инкубация поврежденных клеток,
по-видимому, протекает с репарацией ДНК, вследствие чего темпы роста биомассы
постепенно увеличиваются и примерно к 20-му ч доходят до таковых у необлученных
клеток. Одновременно постепенно восстанавливается способность
колониеобразования. Однако в этом случае даже после 20-часовой инкубации
облученные клетки по способности колониеобразования примерно в 3 раза уступают
необлученным. Возможно, что после облучения в результате репарации ДНК возникает
небольшое количество клеток, образующих колонии, которые отличаются бурным
ростом. Возможно также, что высокое значение количества биомассы у облученных
дрожжей в конце инкубации является не результатом интенсивного роста клеток, а
следствием образования гигантских клеток.
Ереванский государственный
университет
Институт молекулярной биологии
НАН РА
Литература
1. Захаров И. А.,
Кривийский А. С. Радиационная генетика микроорганизмов. М. Атомиздат.
1972. 109 с.
2. Навасардян Л.
А., Марутян С. В., Давтян М. А. - Депонированные научные работы РА. 1995.
N3. С. 24.
3. Корогодин В.
И. - Радиационная биология, радиоэкология. 1999. Т. 39. N6. С. 597-604.
4. Окада Ш. Радиационная
биохимия клетки. М. Мир. 1974.
5. Глазунов А. В. - Радиобиология. 1990. Т. 30. С. 3-16.