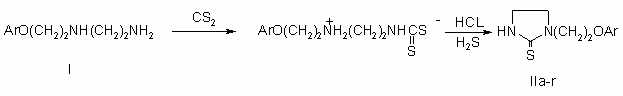Соединения II, являясь производными
тиомочевины, под действием галогенопроизводных превращаются в соли тиурония IIIа-е.
| IIIа-в : Ar = C6H5 (а), м-CH3C6H4
(б), п-CH3C6H4
(в); R =
CH2C6H5 (a-в)
| |
| IIIд-е : Ar = C6H5 (д), м-CH3C6H4
(e),
R=SO2C6H4NHAc-п (д-е) | |
При синтезе тиазолиновых аналогов с
применением ранее разработанного метода [3] найдено, что
арилоксиэтилдитиокарбаматы натрия, реагируя с a-хлорацетоуксусным эфиром и анилидом, превращаются в a-замещенные производные IV, которые при нагревании в толуоле
в присутствии каталитических количеств п-толуолсульфокислоты подвергаются
внутримолекулярной дегидратации с образованием арилоксиэтилпроизводных
тиазолинтионов V.
|
| IVa-в, V a-в :
Ar = C6H5 (а),
п-CH3C6H4
(б),
CL2C6H3 (в), X = OC2H5 (а-в) | |
| IVr-e, Vr-e :
Ar = CH2C6H5 (г),
CI2C6H3 (д), C6H5 (e), X = NHC6H5 (r-e) | |
| IVж, Vж : Ar =
CH2C6H5, X =
OC2H5 | | |
| |
ПМР спектры сняты на приборе "Varian T-60"
(табл. 5). Чистота полученных веществ определена методом ТСХ на пластинке
"Silufol".
1-(2'-Феноксиэтил)-2-тиоксоимидазолидин-1,3
/IIа/. 1.8 г (0.01 моля) b-феноксиэтилэтилендиамина,
растворенного в смеси 2 мл этилового спирта и 2 мл воды, нагревают 2 ч при
60oС, затем при кипячении добавляют 0.07 мл HCl и продолжают
нагревание в течение 8-9 ч. На следующий день выпавший осадок отфильтровывают и
промывают ацетоном. Получают 1.6 г IIа.
1-(2'-о-Толилоксиэтил)-2-тиоксоимидазолидин-1,3 /IIб/,
1-(2'-м-толилоксиэтил)-2-тиоксоимидазолидин-1,3 /IIв/,
1-(2'-п-толилоксиэтил)-2-тиоксоимидазолидин-1,3 /IIг/ получены аналогично IIа
(табл. 1).
Гидрохлорид
1-(2'-феноксиэтил)-2-бензилтиоимидазолин-1,3 /IIIа/. 0.22 г (0.001 моля) IIа и
0.14г (0.0011 моля) бензилхлорида смешивают в среде пропанола и смесь нагревают
6 ч при 95oС. После удаления растворителя получают 0.37 г IIIа.
Гидрохлориды
1-(2'-м-толилоксиэтил)-2-бензилтиоимидазолина-1,3 /IIIб/,
1-(2'-п-толилоксиэтил)-2-бензилтиоимидазолина-1,3 /IIIв/, этилового эфира
1-(2'-о-толилоксиэтил) имидазолин-2-ацетоуксусной кислоты /IIIг/,
1-(2'-феноксиэтил)-2-п-ацетиламинобензолсульфонилтиоимидазолина-1,3 /IIIд/,
1-(2'-м-толилоксиэтил)-2-ацетиламинобензолсульфонилтиоимидазолина-1,3
/IIIе/ получены аналогично IIIа (табл. 2).
Этиловый эфир a-N-феноксиэтилдитиокарбамоилацетоуксусной кислоты /IVа/.
2.25 г (0.01 моля) феноксиэтилдитиокарбамата натрия растворяют в 7 мл воды
и при охлаждении льдом добавляют 1.6 г (0.01 моля) этилового эфира
хлорацетоуксусной кислоты. Смесь перемешивают 4 ч, на следующий день добавляют
20 мл воды, перемешивают и осадок отфильтровывают. Получают 3 г IVа.
Этиловые эфиры a-N-п-толилоксиэтилдитиокарбамоилацетоуксусной
|
Таблица 1
|
Соединение
|
Выход,
% |
Т.пл.,oС |
Найдено, % |
Брутто
формула |
Вычислено, % |
|
N |
S |
N |
S |
|
II a
|
72 |
116-118 |
12.47 |
13.94 |
С11Н14N2OS |
12.61 |
14.41 |
|
II б
|
70 |
108-109 |
11.75 |
13.01 |
С12Н17N2OS |
11.81 |
13.50 |
|
II в
|
70 |
147-148 |
11.65 |
23.97 |
С12Н17N2OS |
11.81 |
13.50 |
|
II г
|
76 |
175-177 |
11.53 |
12.99 |
С12Н17N2OS |
11.81 |
13.50 |
|
|
Таблица 2
|
Соединение
|
Выход,%
|
Т.пл.,oС
|
Найдено,%
Cl
|
Брутто формула
|
Вычислено,% Cl
|
|
III а
|
97
|
70-72
|
10.46
|
C18H21N2OCIS
|
10.19
|
|
III б
|
94
|
80-82
|
10.06
|
C19H23N2OCIS
|
9.79
|
|
III в
|
86
|
98-100
|
9.85
|
C19H23N2OCIS
|
9.79
|
|
III г
|
100
|
68-70
|
8.81
|
C18H25N2O4CIS
|
8.86
|
|
III д
|
86
|
220-222
|
7.75
|
C19H22N3O4CIS2
|
7.79
|
|
III е
|
80
|
218-220
|
7.50
|
C20H24N3O4CIS2
|
7.56 |
|
|
Таблица 3
|
Соединение
|
Выход, % |
Т.пл.,oС |
Найдено, % |
Брутто
формула |
Вычислено, % |
|
N |
S |
N |
S |
|
IV a
|
95 |
96-98 |
4.08 |
19.27 |
С15Н19NO4S2 |
4.10 |
18.77 |
|
IV б
|
90 |
61-62 |
4.17 |
17.65 |
С16Н21NO4S2 |
3.94 |
18.03 |
|
IV в
|
60 |
90-91 |
3.65 |
15.95 |
С15Н17NO4Cl2S2 |
3.41 |
15.61 |
|
IV г
|
95 |
108-109 |
7.00 |
16.07 |
С20Н22N2O3S2 |
6.96 |
15.92 |
|
IV д
|
65 |
84-85 |
5.97 |
13.85 |
С19Н18N2O3Cl2S2 |
6.13 |
14.00 |
|
IV е
|
90 |
90-92 |
6.91 |
16.90 |
С19Н20N2O3S2 |
7.22 |
16.49 |
|
Таблица 4
|
Соединение
|
Выход, % |
Т.пл.,oС |
Найдено, % |
Брутто
формула |
Вычислено, % |
|
N |
S |
N |
S |
|
V a
|
85 |
73-74 |
4.31 |
19.33 |
С15Н17NO3S2 |
4.33 |
19.81 |
|
V е
|
60 |
98-100 |
7.33 |
17.75 |
С19Н18N2O2S2 |
7.56 |
17.29 |
|
V ж
|
65 |
64-65 |
4.35 |
18.64 |
С16Н19NO3S2 |
4.15 |
18.99 |
|
Таблица 5
|
Соединение
|
Спектр ПМР, б.м.д.
( ДМСО )
|
|
II а |
3,5т(2Н,5-CH2),3.82т(2H,4-CH2),
3.85т(2H,6-CH3);
4.18т(2H,7-CH2);
6.85-7.28м(5H,Ph);
8.1c(1H,NH)
|
|
III б |
2,30с(3H,CH3);
3.88т(2Н,6-СН2), 3,92т(2Н,5-СН2), 4,05т(2Н,4-СН2),
4,12т(2Н,7-СН2), 4,90с(2Н,S-CH2);
6.6-7.55м(9Н,Ar);12.0c
|
|
IV a |
1.3т(3Н,СН3СН2),1,8с(3Н,СОСН3),3,85-44,15м(6Н,ОСН2СН2N
и СН2СН3)
4,45с(1Н,SСН), 6,85-7,28
(5Н,Ph );7.66т(1Н,NH
)
|
|
V e |
2.73c(3Н,СН3),
4,36т(2Н,6-СН2), 4,62т(2Н,7-СН2),6,85-7,65м(10Н,Ar
)
9.90c(1H, NH )
|
|
|
|
кислоты /IVб/, a-N-2,4-дихлорфеноксиэтилдитиокарбамоилацетоуксусной
кислоты /IVв /, анилиды a-N-бензилоксиэтилдитиокарбамоилацетоуксусной
кислоты
/IVг/, a-N-2,4-дихлорфеноксиэтилдитиокарбамоилацетоуксусной
кислоты /IVд/, a-N-феноксиэтилдитиокарбамоилацетоуксусной
кислоты
/IVе/ получены аналогично IVа (табл. 3).
Этиловый эфир
2-тиоксо-3-(2'-феноксиэтил)-4-метилтиазолин-5-карбоновой кислоты /Vа/. К 1.7 г
(0.05 моля) IVа добавляют 8 мл толуола и несколько кристалликов
п-толуолсульфокислоты и нагревают на масляной бане в течение 5 ч при температуре
120-125oС. Толуол удаляют, остаток
обрабатывают водой и отфильтровывают. Получают 1.2 г Vа.
Анилид
2-тиоксо-3-(2'-феноксиэтил)-4-метилтиазолин-5-карбоновой кислоты /Vе/ и этиловый
эфир 2-тиоксо-3-(2'-бензилоксиэтил)-4-метилтиазолин-5-карбоновой кислоты /Vж/
получены аналогично Vа (табл. 4). Исходный этиловый эфир a-N-бензилоксиэтилдитиокарбамоилацетоуксусной кислоты IVж
получен в виде густой маслянистой массы и без его выделения подвергнут
внутримолекулярной циклизации.
Армянская сельскохозяйственная
академия
Литература
1. Довлатян В.В., Аветисян Ф.В., Папоян
Т.З., Джаванширян Т.Л., Енгоян А.П. - ДНАН Армении.
2001. Т.101 N 2. С. 146-149.
2.
ÐÐ ³ñïáݳ·Çñ N
676, ²ñ¹ ë»÷. N 4, 1999Ã.
3.
Довлатян В.В., Аветисян
Ф.В., Атарян О.О., Геворкян Р.А., Киноян Ф.С., Мецбурян Дж.А. - Арм. хим. ж. 1999. Т. 52. N 1-2. С.113.