БИОХИМИЯ
УДК 577.1527277:612.8.015
Академик А.А. Галоян, В.А. Шахламов, Л.И. Кондакова, В.И.
Алтухова,
Г.П. Полякова
Анализ влияния нового нейросекреторного пролин-богатого
полипептида гипоталамуса на морфологию и митотическую
активность опухолевых
клеток неврином Гассерова узла крысы
(электронно-микроскопические исследования)
(Представлено 15/V 2001)
Накоплен большой экспериментальный материал,
свидетельствующий о нейропротекторных и иммуномодуляторных свойствах вновь
открытых и выделенных из нейросекреторных гранул гипоталамуса пролин-богатых
полипептидов (ПБП), действующих на иммунокомпетентные клетки крови и нейроны
спинного мозга [1-5]. Опыты, однако, свидетельствуют, что ПБП заметно,
дозозависимо ингибирует пролиферативную активность опухолевых лимфоцитов
человека (Jurkat cell) (in vitro) [6], а также оказывает разрушительное влияние
на ультраструктуру опухолевых клеток фибробластов - L929 [7]. Недавно
удалось показать, что ПБП обладает вирулицидной активностью в отношении вируса
энцефаломиокардита [8].
Данные анализа ультраструктуры в монослойной
культуре L929 свидетельствуют, что ПБП в концентрации 10-5М подвергает разрушению опухолевые клетки, действуя
на их ультраструктуру. Разрушению подвергаются как зрелые, так и незрелые
опухолевые клетки. Прежде всего гибнет энергетическая система клеток
(митохондрии). Одновременно страдает и плазмалемма (явление микроплазмaтоза).
Усиливается синтез белков цитоплазмы (моно- и полисомы). Спустя 24 ч после
вoздействия пептида in vitro происходит разрушение клетки, которое для зрелых
опухолевых клеток происходит путем фрагментации ядра и цитоплазмы, а для
незрелых - внезапного разрушения ядeр (кариопикноз, кариорексис и кариолизис).
Всюду в препаратах при большой концентрации пептида (5×10-5М) встречаются разрушенные мембраны и
фрагментированные цитоплазматические отростки.
Представляло значительный интерес изучить
влияние ПБП на нервные клетки в условиях in vitro. С этой целью мы исследовали
влияние ПБП на морфологию, ультраструктуру и митотическую активность клеток
невриномы Гассерового узла крыс.
Моделью для исследования послужила уникальная
клеточная линия невриномы Гассерова узла крысы (НГУК-1), полученная и
поддерживаемая в Лаборатории экспериментальной нейроонкологии НИИ морфологии
человека РАМН [9].
Эта культура нашла широкое применение в
биотехнологии, используется для диагностики бешенства, для определения
глиотоксичности сыворотки крови неврологических больных и титрования
интерферона, а в последнее время служит адекватной моделью для изучения и
диагностики прионовых инфекционных болезней [10].
Культуру клеток выращивали на среде RPMI
фирмы "Flow" (85%) с добавлением эмбриональной сыворотки коров (15%) и
гентамицина (100 ед./мл). Морфологию и митотический режим клеточной линии НГУК-1
изучали в контроле и в присутствии нового нейропептида ПБП в концентрации
5×10-3М через 24 ч. Стекла фиксировали в
жидкости Карнуа, окрашивали гематоксилином Коуля - эозином. Учет показателей
митотического режима проводили по методическим указаниям И.А. Алова с соавт.
[11].
Для электронно-микроскопического исследования
использовали нейропептид в двух концентрациях - 5×10-3 и 5×10-5М.
Клетки с флаконов смывали раствором Версена, суспендировали в ростовой среде,
центрифугировали в течение 3 мин при 1500 об./мин. Осадок фиксировали 2.5%-ным
глютаральдегидом на 0.1М какодилатном буфере при pH 7.4 в течение 30 мин,
отмывали в 0.1М какодилатном буфере, дополнительно фиксировали 2%-ным раствором
четырехокиси осмия на том же буфере в течение 1 ч, отмывали в буфере,
обезвоживали в растворах ацетона восходящей концентрации, заливали в смесь ЭПОНа
с аралдитом.
Ультратонкие срезы получали на ультратоме LKB
(Швеция), контрастировали препаратами свинца по Рейнольдсу и просматривали в
электронном микроскопе JEM-100B.
Полученные светооптические данные показали,
что в присутствии нейропептида митотический режим клеточной линии НГУК-1,
находящейся в логарифмической фазе роста, превышает контрольные значения в 1.6
раза. Гигантские клетки в эксперименте всречаются в 1.3 раза чаще, чем в
интактных культурах. Однако индекс патологических митозов не увеличен, а,
наоборот, понижен в 1.6 раза по сравнению с контролем. Преобладания какой-либо
определенной формы патологии деления не наблюдается. Цитоморфологическая картина
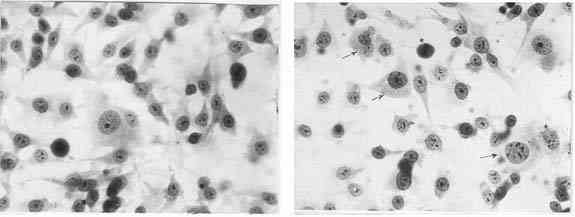
культуры в присутствии нейропептида не отличается от интактной (рис. 1, а).
|
|
а
б
Рис.1
Анализ митотического режима клеточной линии
НГУК-1 в присутствии нейропептида ПБП позволяет сделать вывод о некоторой
стимуляции пролиферативной активности культуры данным препаратом на фоне
снижения числа патологических митозов и незначительного увеличения количества
гигантских клеток (рис. 1, б).
Рис.2
При электронно-микроскопическом исследовании
НГУК-1 в присутствии ПБП в концентрации 5×10-3М через 24 ч наблюдали клетки с ячеистой структурой
цитоплазмы вследствие расширенных полостей гладкого эндоплазматического
ретикулума (рис. 2). В контроле таких изменений не отмечается (рис. 3).
Рис.3
При концентрации пептида ПБП 5×10-5М в культуре на ультратонких срезах выявлены
фрагменты разрушенных электронноплотных ядер, окруженных мембранами, что
указывает на наличие начальных стадий апоптоза опухолевых клеток (рис. 4).
Рис.4
Таким образом, в условиях in vitro ПБП в
концентрациях 5×10-3-10-7М оказывает
подавляющее влияние на фибробласты L929 Jurkat клеток и на клетки
невриномы Гассерова узла крысы.
Электронно-микроскопические исследования
выявляют признаки ячеистой структуры цитоплазмы вследствие расширения полостей
гладкого эндоплазматического ретикулума. Фрагменты разрушенных электронноплотных
ядер, окруженных мембранами, указывают на наличие начальных стадий апоптоза этих
опухолевых нервных клеток (НГУК-1). В случае с опухолевыми клетками фибробластов
(L929) ПБП в концентрации 5×10-5М
изменяет ультраструктуру как зрелых, так и незрелых опухолевых клеток. Для
зрелых клеток эти изменения заключаются в резком расширении агранулярной
цитоплазматической сети, фрагментации ядра и цитоплазмы, разрушении внутренних
мембран набухших митохондрий.
Что же касается незрелых клеток, то они
подвергаются другому виду изменений - в ультраструктуре появляются пикнотические
ядра, ядра с кариорексисом и кариолизисом, резко выражен микроплазматоз.
Ультрамикроскопические данные показывают разрушение типа апоптоза как в нервных
опухолевых, так и опухолевых клетках фибробластов (L929). При этом
наблюдается подавление митотической активности клеток L929. Хотя мы
не проводили электронно-микроскопических исследований опухолевых клеток
Т-лимфоцитов человека (Jurkat cells) при воздействии ПБП в культуре клеток,
однако мы констатировали дозозависимое угнетающее влияние ПБП на пролиферацию
этих клеток, что согласуется с данными по влиянию ПБП на культуру опухолевых
клеток фибробластов (L929) in vitro. Вместе с тем ПБП потенцирует
ИЛ-2 зависимые функции лимфоцитов человека в культуре.
Ранее мы показали, что ПБП в концентрации
5×10-5М подавляет КонА стимулируемую реакцию
бласт-трансформации тонзилярных лимфоцитов человека в культуре, хотя сам КонА
стимулирует бласт-трансформацию. Интерлейкин-2 также стимулирует
бласт-трансформацию лимфоцитов, но в отличие от КонА при сочетании ИЛ-2 с ПБП
значительно увеличивает содержание бласт-трансформированных клеток. Такая же
картина наблюдается при изучении влияния ПБП на активность
лимфокин-активированных киллеров, а также на антигензависимую Т-клеточную
цитотоксичность при наличии экзогенного интерлейкина-2. Таким образом, ПБП
потенцирует ИЛ-2 зависимые функции лимфоцитов человека в культуре. Более того,
ПБП стимулирует образование антител против ряда микроорганизмов в условиях как
in vitro, так и in vivo [5].
Наши опыты по изучению влияния ПБП на
лимфоциты периферической крови человека различного возраста и пола, на ИЛ-2
индуцируемую клеточную пролиферацию мононуклеарных клеток показали, что
Т-клеточные ответы на фитогемагглютинин при добавлении ПБП в культуру клеток
происходит следующим образом: низкоотвечающие доноры реагируют усилением
пролиферационного ответа, тогда как у лиц с высоким уровнем Т-клеточной
пролиферации на ФГА тестируемый пептид в той или иной мере угнетает ответ на
клеточный митоген. В нормальных лимфоцитах человека ПБП не вызывает
патологических морфологических или функциональных сдвигов, а скорее оказывает
модулирующее действие на лимфоциты цельной крови. Мы показали, что при перерезке
спинного мозга и воздействии змеиного яда, когда происходят
дегенеративно-некротические процессы нейронов, ПБП восстанавливает не только
функцию нейронов (электрическая активность), но и всю морфологическую картину
как интер-, так и мотонейронов [2,3].
Хотя трудно делать определенные выводы о
механизме влияния ПБП на ультраструктуру различных видов клеток, однако
полученные данные свидетельствуют о наибольшем сходстве с действием ПБП на
указанные виды опухолевых клеток. В настоящее время А.А. Галояном и сотр.
проводятся широкие биохимические, нейроиммунохимические и генетические
исследования для выяснения роли ligand-gated каскадной системы в опухолевых
лимфоцитах и нейронах, приводящих к апатотическим сдвигам этих клеток. В этом
отношении большой интерес вызывало влияние ПБП на активность каспаз. Объектом
была культура нейробластомы N2A, обладающая нейроноподобными свойствами. Опыты
показали, что ПБП в концентрации 10-9М
оказывает разнонаправленное влияние на активность каспаз (2, 6, 3 и 9
нейробластомы N2A в культуре). ПБП подавляет эффекторные ферменты каспаз 3 и 9,
значительно активируя каспазы 2 и 6, совершенно не действуя на активность каспаз
8. Причем ПБП не меняет активность влияния указанных каспаз на
недифференцированные нейробластомы. После дифференцировки этих клеток бутиратом
ПБП воздействует на их активность [12].
Возникает два вопроса: 1) чем отличаются
генетически и биохимически дифференцированная и недифференцированная
нейробластомы, 2) почему ПБП оказывает нейропротекторное влияние на клетки
спинного мозга, но разрушает опухолевые клетки (НГУК-1) и фибробласты
L929?
По-видимому, ПБП может оказывать влияние на
жизнедеятельность различных лимфоцитов и других клеток на различных уровнях их
дифференцировки и функционального состояния, о чем свидетельствуют данные о
влиянии ПБП на активность лимфоцитов крови разных доноров [6]. ПБП обладает
также свойствами NGF, оказывая влияние как на нейроны, так и на глиальные клетки
и стимулируя образование GFAP в глиальных клетках и интерлейкинов в астроцитах.
Зачастую трансформированные клеточные линии, так же как малиглинизирующие
клетки, изолированные из опухолей, являются более чуствительными к
проапоптотическим стимулам, чем нормальные клетки [13].
Проведенные исследования позволили нам
сделать следующие выводы:
1. Нейропептид ПБП в концентрации 5-10-9М через 24 ч не
вызывает изменений морфологии клеточной культуры НГУК-1 на светооптическом
уровне.
2. ПБП оказывает слабовыраженный митогенный
эффект на НГУК-1, не провоцируя дополнительных форм патологических митозов,
характерных для данной опухолевой линии.
3. ПБП вызывает сравнительно небольшое
увеличение числа гигантских клеток в культуре НГУК-1, что свидетельствует о
нарушении цитотомии.
4. Нейропептид в концентрации 5-10-3 и 5-10-5М оказывает
цитотоксическое действие на отдельные опухолевые клетки, что проявляется в виде
картин клеточной деструкции и апоптоза (электронно-микроскопическое
исследование).
Институт биохимии им. Г.Х. Бунятяна
НАН РА
Институт морфологии человека РАМН
Литература
1. Galoyan A.A. Biochemistry of Novel Cardioactive Hormones and Immunomodulators of the
Functional System Neurosecretory Hypothalamus - Endocrine Heart. M. Nauka
publishers. 1977. P. 240.
2. Galoyan A.A., Kipriyan T.K., Sarkissian J.S., Sarkissian E.J., Grigorian
Y.Kh., Andreasian A.S., Chavushyan E.A. - Neurochemical
Research. 2000. V. 25. N. 6. P. 791-800.
3. Galoyan A.A., Sarkissian J.S., Kipriyan T.K., Sarkissian E.J.,
Grigorian Y.Kh., Sulkhanyan R.M., Khachatrian T.S. -
Neurochemical Research. 2000. V. 25. N. 12. P.
1567-1578.
4. Galoyan A.A.
- Neurochemical Research. 2000. V. 25. N. 9/10. P.
1343-1355.
5. Априкян В.С.,
Галоян А.А. -Мед. наука Армении, 1999. Т. 39. N 2. С.
23-29.
6. Галоян А.А., Шахламов
В.А., Агаджанов М.И., Ваградян А.Г., Богданова В.В. -Нейрохимия, 2001. т. 18. N 3.
7. Галоян А.А., Шахламов В.А., Багданов В.В., Малайцев Т.С. -Мед. наука Армении, 1/2001.
8. Галоян А.А., Камалян Л.А., Гаспарян М.Г. -ДНАН
Армении, 2000. Т. 100. N 3. С. 276-282.
9. Авцын А.П., Кондакова Л.И., Халанский А.С., Полякова Г.П.,
Чудиновская Н.В. -Цитология, 1989. Т.31. N1. С.
97-101.
10. Завалишин И.А.,
Ройхель В.М., Кондакова Л.И. и др. -Ж. неврологии и
психиатрии., 1998. Т.98. N5. С. 20-25.
11. Алов И.А., Аспиз М.Е., Казанцева И.А. -М.
1973. С. 14.
12. Galoyan A.A.,
Tezio N., Berg M., Marks N. - Нейрохимия 2000. Т. 17. N 3.
С. 185-188.
13. Fujimo Keiji,
Iwasaki Chizn, Kawaguchi Haruma, Yasugi Etsuko, Oshima Mieko. - FEBS Letters. 1999. V. 446. P. 113-116.
