УДК 576.31
О структурно-химической организации биологических
мембран и их биогенезе
(Представлено академиком В. В. Фанарджяном 23/XI 2000)
Наиболее распространенным представлением о структурной организации плазматической мембраны, совпадающим с электронно-микроскопической картиной ее искусственной модели, является трехслойная конструкция. Она создается двумя мономолекулярными слоями липидов общей толщиной 3,5 нм, которые своими полярными головками обращены к покрывающим с обеих сторон белковым слоям толщиной 2 нм. Толщина билипидного слоя меньше длины двух полностью развернутых фосфолипидных молекул на поверхности жидкости, что свидетельствует о возможном их сжатии в мономолекулярных пленках [1]. На основе указанного устройства мембраны предложены различные модифицированные модели ее молекулярной организации [1-4]. Однако, по мнению Э. де Робертис, эти модели не могут объяснить присущего мембранам высокого электрического сопротивления[1]. Химические компоненты мембраны наиболее полно представлены в "гибридной" модели, учитывающей асимметрию состава ее слоев [4]. Есть немало приверженцев субъединичной - глобулярной организации мембраны. Размер глобул варьирует в пределах 5-9 нм, из которых на электронно-оптически плотную оболочку приходится приблизительно 1-2 нм [3]. Такой же величины глобулы обнаруживаются в мембранах методом замораживания-скалывания. При диспергировании биологических мембран выделены липопротеиновые субъединицы, размеры которых, по данным электронной микроскопии и седиментации, соответствуют размерам глобул, обнаруживаемых в мембранах при электронно-микроскопическом исследовании клеток [3]. Нередко в одном и том же материале выявляется и ламеллярная, и глобулярная организация, что рассматривается как результат различного их функционального состояния [3], но никак не может свидетельствовать о нестандартных условиях обработки материала [4].
|
|
Согласно жидкостно-мозаичной модели [5] мембрана представляет собой вязкий двухмерный раствор амфипатических белков или липопротеидов и липидов, которые находятся в термодинамическом равновесии. Белки подразделяются на интегральные (внутренние) и перифирические (внешние). Именно внутренние амфипатические белки выполняют мембранообразующую роль в присутствии липидов [5]. В последние годы, благодаря внедрению атомно-силового метода, получены интересные данные о клеточных мембранах и их свойствах [6]. Однако трансмиссионная электронная микроскопия, как нам кажется, еще не изжила себя. К тому же определенный интерес может представить новая трактовка известных фактов в связи с предлагаемой в настоящей работе гипотезой о структурно-химической организации указанных мембран и их биогенезе. Она основана на результатах изучения внутримембранных частиц (ВМЧ) различных мембран миокарда человека и экспериментальных животных с помощью трансмиссионной электронной микроскопии [7-13]. Величина этих частиц настолько мала (5-10 нм на срезах ткани), что исключает применение метода объемной реконструкции на серийных срезах, так как самый тонкий срез может включать два ряда частиц. Поэтому их трехмерная модель была предложена на основании анализа срезов ВМЧ в различных плоскостях [11]. В соответствии с данными литературы о липопротеидной природе мембранных субъединиц [1-3, 5, 9, 11] и доминирующей роли белка в создании электронно-микроскопической картины мембраны [3] мы допустили, что радиально расположенные электронно-прозрачные молекулы фосфолипидов сосредоточены в "головке" ВМЧ,
|
|
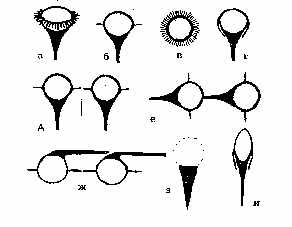
покрытой снаружи слоем белка толщиной 1-2 нм. Последний формирует также филаменты и "хвост" частицы (рис. 1,а). На рис. 2,а белок представлен в b-форме, хотя не исключается a-спиральная и глобулярная конструкции структурного белка (рис. 2,б). Глобулы последнего имеют форму запятых и ассоциируются по принципу "голова-хвост". Тот же принцип лежит в основе самосборки мембран при их новообразовании [9, 11, 13]. При слиянии же мембран наблюдается встраивание ВМЧ в предшествующую мембрану (рис. 1,д). Ведущая роль в процессе самосборки мембраны отводится структурному амфипатическому белку, который в присутствии липидов самопроизвольно формирует белково-липидные мицеллы [5]. На рис. 1,ж изображен предполагаемый механизм сборки биологической мембраны из ВМЧ, которые, располагаясь на расстоянии диаметра "головки" одной частицы, соединяются попарно изогнутыми под углом 90° "хвостами", контактирующими с "головками" соседних частиц попеременно сверху и снизу. В смежных рядах пары чередуются, поэтому мембрана на перпендикулярном срезе через нее кажется склеенной из шариков, ввиду просвечивания частиц смежного ряда, имеющих гексагональную упаковку, т. e. расположенных в промежутках между ВМЧ первого ряда (рис. 3,а). Выпрямленные "хвосты" выходят за пределы мембраны, оставляя впечатление интегральных белков, а в плоскости мембраны их можно принять за периферические белки (рис. 2,а). Параллельно расположенные "хвосты" одной пары ВМЧ образуют поры в мембране, которые могут открываться при складывании филаментов в сторону "хвоста" и закрываться при их расправлении. Можно допустить, что филаменты не выворачиваются в направлении головки и действуют как клапаны. Тогда легко представить две соседние поры, осуществляющие транспорт веществ в противоположных направлениях. Такой механизм может объяснить противоток, в частности, ионов натрия и калия [2]. Известно, что в норме мембрана пропускает частицы диаметром 0,4-0,6 нм [4]. Это, по-видимому, обусловлено щелями между филаментами каждой ВМЧ, а также филаментами ВМЧ смежных рядов (маленькие треугольной формы отверстия, которые отмечены на рис. 3,б). Открытая пора может пропустить частицы диаметром 7-9 нм. "Хвосты" же состыкованных пар ВМЧ в плоскости мембраны образуют некое подобие сита с обеих сторон мембраны, которое не пропускает крупные частицы. Мы не исключаем множества различных вариантов связи ВМЧ, в частности, смежных рядов в плоскости мембраны, которые невозможно охватить в одной работе. Об одном из вариантов связи шести пар гексагонально упакованных ВМЧ в смежных мембранах электрического синапса, формирующих сотовидные структуры "ионных каналов" на тангенциальном срезе через синаптическую щель, сообщалось ранее [12]. Перпендикулярное расположение "хвостов" ВМЧ к плоскости мембраны, придающих ей поперечно-исчерченный вид, объяснялось ранее переориентацией самих частиц на 90° [8, 11]. Это, на наш взгляд, менее правдоподобно,чем переориентация гибких "хвостов", если учитывать асимметрию химического состава слоев мембраны [4]. Переход глобулярной конструкции мембраны в ламеллярную возможен в результате описанной клиновидной трансформации ВМЧ [12], при которой белковая оболочка ВМЧ, по нашему мнению, сползает с "головки" к основанию "хвоста" и обнаженная липидная мицелла больше не видна под пучком электронов (рис. 1,з), хотя нельзя исключить также истинный переход ее в бислой фосфолипидов, предусматриваемый в прежних моделях молекулярного строения мембраны. Бреши белковых слоев мембраны возникают в тех участках, где "головки" ВМЧ остались не покрытыми "хвостами" и лишились белковой оболочки из-за клиновидной трансформации. Несколько изогнутые изолированные "хвосты" создают картину прерывистых, в виде пунктира, белковых слоев [1] или комочков периферических белков [5]. Мембрана в этих случаях скорее всего более доступна для жирорастворимых веществ, более гидрофобна и уязвима для эндогенных и экзогенных фосфолипаз, в отличие от глобулярной организации, обуславливающей большую ее гидрофильность и проницаемость для водорастворимых веществ.
|
|
Рис. 3. Вид мембраны на срезе и сверху: а - вид мембраны на
срезе,
перпендикулярном плоскости мембраны (цифрами отмечены частицы одного
ряда,
Следует отметить, что дезинтеграция
мембран на субъединицы возможна как в физиологических (ядерная мембрана при
митозе), так и экспериментальных [4] и патологических условиях. В последних
случаях, по-видимому, необратимо разрушаются "хвосты" и филаменты ВМЧ и
наступает везикуляция мембраны [14].
Описанная
структурно-химическая организация мембраны обеспечивает ей достаточную
прочность, гибкость, способность изменять свою форму и образовывать различные
дериваты. Она же объясняет многие ее свойства, избирательную проницаемость в том
числе. Возможно, с помощью этой модели станут понятными высокое электрическое
сопротивление и быстрота распространения нервного импульса, не поддающиеся
объяснению на основе существующих представлений о конструкции биологических
мембран. Эта модель позволила также пересмотреть механизм формирования
межмембранных контактов вообще, и межмитохондриальных соединений и синапсов в
частности [11,12].
Однако указанная конструкция
биологической мембраны порождает не меньше новых вопросов, на которые пока
невозможно ответить, как, например, чем обусловлена парная комплектация ВМЧ с
помощью "хвостов" с противоположных сторон мембраны (если это вообще
соответствует действительности); существует ли какая-либо пространственная,
химическая и прочая гетерогенность ВМЧ или их половинок при переходе глобулярной
структуры в ламеллярную, если этот переход в действительности происходит; почему
филаменты складываются в сторону хвоста и многое другое.
И
тем не менее, эта гипотеза, на наш взгляд, имеет право на существование, а
главное, нуждается в проверке и подтверждении новейшими методами исследования
биологических мембран.
Институт физиологии им. акад.
Л.А.Орбели НАН РА
1. Робертис Э. де, Новинский В., Саэс Ф. Биология клетки. М. Мир, 1973. 487 с.
2.
Леви А., Сикевиц Ф. Структура и функции клетки. М.
Мир, 1971. 583 с.
3. Комиссарчик Я.Ю. В кн.: Структура и функции биологических мембран. М. Наука, 1975.
С. 8-25.
4. Авцын А.П., Шахламов В.А. Ультраструктурные основы патологии клетки. М. Медицина. 1979. 320
с.
5. Singer S.J., Nicolson G.L. - Sciens. 1972. V. 175. P. 720.
6. Митюхина Т.Г. - Морфология. 1999. № 1. С.
51-54.
7. Аглинцян Т.С. Матер.
конф. АОЭМ "Электронная микроскопия - 97". Ереван. 1997. С.
43.
8. Aglintsyan T.S. Proc.
of VIII annual Conference of AEMS Ëlectron microscopy - 1998". Erevan. 1999. P.
7.
9. Аглинцян Т.С. - Вестн.
хирургии Армении. 1999. № 1-2. С. 140-142
10. Aglintsyan T.S.
Thes. of Third Conferance of Armenian
International Brain Research organization (IBRO) Association. Yerevan. 2000. P.
14.
11. Aglintsyan T.S. Proc.
of IX annuale conferance of AEMS "Electron microscopy-2000." Yerevan. 2000. P.
7-8.
12. Aglintsyan T.S. Ibid
P. 9-10.
13. Аглинцян Т.С. Матер. II конф. Ассоциации морфологов Армении (АГЭ), посвященной
70-летию Ереванского Гос. Мед. Ун. Ереван. 2000.
С. 10-11.
14. Кукуртчян Н.С., Аглинцян Т.С. - Кровообращение. 1990. Т.
23. № 3. С. 3-7.