УДК 611.817.311
Анализ
эффектов переключения нисходящих
супраспинальных влияний на двигательную
активность
(Представлено 3/VIII 2000)
Кортикоспинальная и руброспинальная системы
являются двумя нисходящими прекционными путями, которые контролируют спинальные
моторные нейроны. Установлено большое сходство в структурной и
функциональной организации этих двух трактов, входящих в состав латеральной
системы нисходящих путей спинного мозга [1, 2]. Показан
параллелизм между развитием нисходящих путей и моторикой
животного. Использование всех конечностей соответствует тому периоду, когда
руброспинальный тракт устанавливает контакты со спинальными нейронами
[3]. Совершенствование точностных движений связано с увеличением
латерального мозжечка, его связей с корой мозга и мелкоклеточной части красного
ядра (КЯ). Расширение репертуара движений отражает развитие более высоких
уровней интеграции, представленных структурами гипоталамуса, субталамуса,
претектумом и другими образованиями, проецирующимися в КЯ. Эти проекционные
системы филогенетически предшествуют возникновению моторной коры и пирамидного
тракта. Появление последних знаменует собой совершенно новый этап регуляции
двигательной активности, в частности нисходящей моторной системы
КЯ. Последнее на этом этапе представляет основную структуру для координации
мозжечковых и корковых посылок для контроля движений. Ниже рассмотрены
результаты изучения механизмов переключения нисходящих кортикоспинальных и
кортико-руброспинальных влияний на двигательную активность.
Исследование было проведено на нелинейных
белых крысах в возрасте 2-3 месяца с массой тела
210-250 г, у которых вырабатывались инструментальные рефлексы на равновесие
[4-6]. Работа была выполнена на трех группах животных и состояла из
нескольких серий экспериментов.
|
|
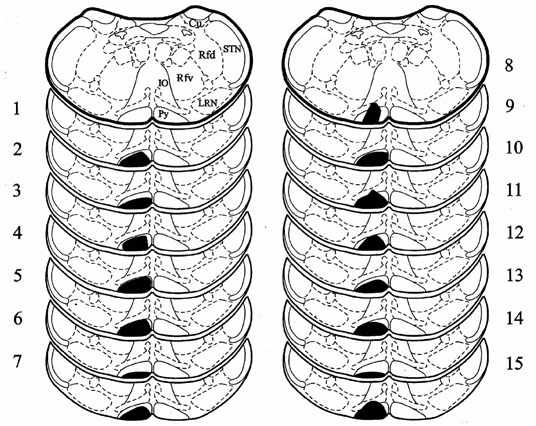
Рис. 1. Схема фронтальных срезов продолговатого мозга крысы [9]. Затемнена область
У первой группы крыс после выработки прочных
инструментальных рефлексов в течение 2-4 дней (в среднем 2.5±0.5; n=67) под нембуталовым наркозом производилась
унилатеральная перерезка дорсолатерального канатика спинного мозга, в котором
проходит руброспинальный тракт (первая серия). Перерезка производилась в
области шейных сегментов спинного мозга (C3), что приводило к парезу
гомолатеральных передней и задней лап в течение 5-7 дней. На 5-7-е сутки у
животных возобновлялась выработка инструментальных рефлексов, которые
упрочивались на 4-13-й день (в среднем на 8.3±3.9;
n=27). Во второй серии опытов у крыс с прочными инструментальными
рефлексами было произведено электролитическое унилатеральное разрушение КЯ, что
приводило к двигательным расстройствам в виде пареза конечностей на
контралатеральной к разрушению стороне. На 5-10-й день после оперативного
вмешательства, после компенсации двигательного дефицита (величина которого
зависела от степени разрушения КЯ), выработка инструментального рефлекса
возобновлялась и прочные рефлексы выявились на 17-22-й опытный день (в среднем
на 18.3±3.2; n=6). В третьей серии опытов у крыс
из первой серии на 16-17-й день после унилатеральной перерезки руброспинального
тракта было произведено электролитическое разрушение контралатерального КЯ, что
привело к картине двигательных расстройств, наблюдаемых после изолированного
разрушения КЯ. На 7-10-й день после операции была возобновлена выработка
инструментальных рефлексов, которые стали прочными на 12-16-й день (в среднем на
14.2±0.5; n=6). В проведенных опытах
электролитическое разрушение КЯ не только вызывало повреждение нейронных
элементов этого образования, но и приводило к перерыву мозжечково-таламических
волокон, проходящих через КЯ к вентролатеральному ядру таламуса и отдающих
коллатерали к рубральным нейронам. В связи с этим были проведены опыты
(четвертая серия) с химическим разрушением КЯ посредством введения в него
хинолиновой кислоты (Quinolinic acid, Sigma), которая, разрушая нейронные тела
КЯ, оставляла сохранными мозжечково-таламические волокна. Проведенные опыты
показали, что после химического разрушения КЯ двигательные нарушения
компенсировались и стабильные инструментальные рефлексы восстанавливались на
18-27-й день (в среднем на 22.2±3.4; n=4). В то же
время в экспериментах с предварительной перерезкой руброспинального тракта и с
последующим химическим разрушением КЯ прочные инструментальные рефлексы
восстанавливались на 6-10-й опытный день (в среднем на 8.25±1.6; n=4). По завершению опытов применение метода
окраски пероксидазой хрена (Horseradish Peroxidase, Type VI, Sigma) показало,
что в результате действия хинолиновой кислоты наблюдается разрушение тел
рубральных нейронов и сохранность проходящих в КЯ мозжечково-таламических
волокон [7]. Рис. 2. Перерезка пирамиды. Микрофотография сагиттального среза
Имеется основание более быстрое восстановление рубрального дефекта после
перерезки руброспинального тракта по сравнению с изолированным разрушением КЯ
рассматривать как следствие активации рубро-оливарной проекции, приводящей к
переключению двигательной активности под контроль кортикоспинального тракта [4,
5]. Эта перестройка осуществляется благодаря вовлечению мозжечка и
вентролатерального ядра таламуса, передающих информацию в кору
мозга. Разрушение КЯ без предварительной перерезки руброспинального тракта
завершается более тяжелыми нарушениями в связи с тем, что такое вмешательство
приводит к одновременному выключению рубро-оливарного и руброспинального трактов
и поэтому нет переключения на кортикоспинальный тракт, который остается
интактным [8]. Рис. 3. Повреждения коры мозга. Использована схема коры мозга
крысы [10], в которой У второй группы животных
рассматривалась возможность переключающего действия рубро-оливарной проекции с
кортикоспинальной системы (в случае ее повреждения) на кортико-руброспинальную
систему. С этой целью была разработана модель опытов, исследующая влияние
предварительной односторонней поперечной перерезки бульбарной пирамиды
(пирамидотомии) на поведение и компенсаторно-восстановительные процессы у крыс
после удаления сенсомоторной коры на той же стороне. В первой серии
экспериментов было показано, что у крыс с прочными инструментальными рефлексами
пирамидотомия приводит к их нарушению в течениe 3-7 дней
(в среднем 3.9±1.3;
n=7) (рис. 1,2). Последующее унилатеральное удаление
сенсомоторной коры вызывало более глубокие нарушения моторики животного с
выраженным парезом контралатеральных конечностей. Инструментальные рефлексы
стали прочными на 7-11-й послеоперационный день (в среднем на 9.2±1.8; n=7). Во второй серии экспериментов у крыс с
прочно выработанными рефлексами производилось изолированное унилатеральное
удаление сенсомоторной коры. После этой операции рефлексы упрочились на
14-26-й день (в среднем на 19.0±5.9;
n=5). Следовательно, предварительная пирамидотомия оказывает четкое
облегчающее влияние на восстановление двигательной активности и инструментальных
рефлексов после удаления сенсомоторной коры (сравни 19.0 и 9.2 дня).
Институт физиологии им. Л. А. Орбели НАН РА
перерезки пирамиды. Правая сторона представлена справа. Цифры - номера животных.
Пирамидотомия
произведенапосле (крысы 1-8) и до (крысы 8-15) выработки рефлексов.
Обозначения: Py - пирамидный тракт; IO - нижняя олива; LRN - латеральное
ретикулярное ядро;
STN - спинальное тройничное ядро; Cu - клиновидное ядро;
Rfd - дорсальное ретикулярное поле продолговатого мозга; Rfv - вентральное ретикулярное поле
продолговатого мозга.
Проведенные опыты показали
облегчающее влияние предварительной перерезки руброспинального тракта на
восстановление двигательной активности и инструментальных рефлексов после
разрушения КЯ [5, 6]. Время облегчения выявилось как разница, между
временем восстановления инструментальных рефлексов после изолированного
разрушения КЯ и после разрушения КЯ, с предшествовавшей перерезкой
руброспинального тракта. В случае электролитического разрушения КЯ
указанное время составило 4.1 дня (18.3-14.2) или 5.8 дня (20.0-14.2), при
химическом же разрушении - 14.0 дня (22.2-8.25) (статистически достоверное
различие, p < 0.005). Следовательно, облегчающее влияние предварительной
поперечной перерезки руброспинального тракта более четко выражено при химическом
разрушении КЯ, чем при его электролитическом разрушении, что должно быть
объяснено сохранностью мозжечково-таламических волокон к вентролатеральному ядру
таламуса.

каудального отдела продолговатого мозга крысы после унилатеральной
пирамидотомии. Стрелка указывает место поперечной
перерезки пирамиды.
Видны поврежденные миелиновые волокона. Калибровка: 550 мкм.
Поскольку вентролатеральное
таламическое ядро представляет одно из ключевых образований в переключении
нисходящих влияний, в следующей (пятой) серии экспериментов у крыс с прочно
выработанными рефлексами производилось электролитическое разрушение этого
ядра. У оперированных животных моторные нарушения контралатеральной
половины тела ослабевали к 5-10-му дню после операции и прочные инструментальные
рефлексы выявились к 17-21-му дню (в среднем 19.8±2.1;
n=7). В шестой серии опытов у крыс предварительно производилась перерезка
руброспинального тракта и на 15-23-й день электролитически разрушалось
вентролатеральное ядро таламуса. Инструментальные рефлексы
стабилизировались на 5-13-й день (в среднем на 9.1±3.1;
n=6). Таким образом, и в этих опытах выявилось облегчающее влияние
предварительной перерезки руброспинального тракта на восстановление
инструментальных рефлексов и компенсаторные процессы после разрушения
вентролатерального ядра таламуса. В седьмой серии опытов у 11 крыс
разрушение вентролатерального ядра таламуса было произведено до выработки
инструментальных рефлексов. В последующем у этих животных последовательно
производилась перерезка руброспинального тракта и разрушение
КЯ. Прослеживание за динамикой поведения показало, что у крыс с разрушенным
вентролатеральным ядром таламуса сильно затруднено переключение двигательной
активности под контроль кортикоспинального тракта. Разрушение
вентролатерального ядра таламуса существенно ослабляет инструментальные
рефлексы, которые после перерезки руброспинального тракта становятся непрочными,
а после разрушения КЯ у части животных перестают
выявляться. Предварительное выключение вентролатерального ядра таламуса
практически лишает кору мозга восходящих, сигнализирующих о дефектах мозжечковых
воздействий на кортикоспинальную систему, без которых затруднена
контрольно-корректирующая функция в нисходящих влияниях на двигательный
аппарат [6].
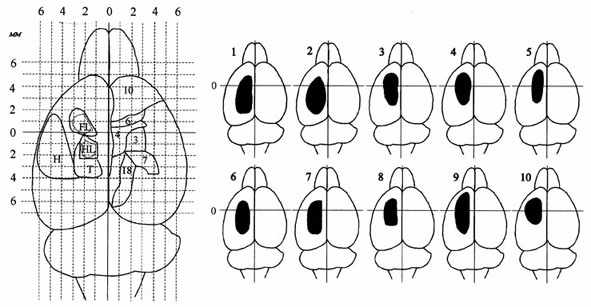
в продольной шкале (в мм) фронтальный план, проходящий через коронарный
шов
(брегму), соответствует "0"; справа представлены цитоархитектонические поля (3, 4, 6 и др).
Слева даны области, раздражение которых вызывает движения передних (FL), задних (HL)
конечностей,
тела (T), головы (Н). Правое полушарие показано справа. Удаленные участки
коры затемнены.
Цифры обозначают номера животных. Сенсомоторная область кора мозга
удалена после (крысы 1-5) и
до (крысы 6-10) выработки рефлексов.
У третьей группы животных исследовались
эффекты пирамидотомии на инструментальные рефлексы у крыс в зависимости от
времени ее проведения. У животных предварительно производилась
пирамидотомия (рис. 1) и после восстановления неврологического статуса
начиналась выработка инструментальных рефлексов. Прочный рефлекс был
выработан на 14-24-й день (в среднем на 16.5±3.16;
n=8). Сравнение результатов, полученных у крыс второй и третьей групп,
показало большое различие во времени стабилизации инструментальных рефлексов
(сравни 3.9 и 16.5 дня) (статистически достоверное различие, p <
0.005). Определяющим фактором было время выполнения
пирамидотомии. Различие между двумя группами выявилось и при последующем
удалении сенсомоторной области коры мозга (рис. 3). У крыс второй
группы, как было отмечено, инструментальные рефлексы после коркового
вмешательства упрочились в среднем на 9.2 день, тогда как у крыс третьей группы
инструментальные рефлексы стали прочными лишь на 11-29-й день (в среднем на
21.4±6.3; n=5). Следовательно, феномен усиления
кортикофугальной пластичности, четко обнаруживаемый в результате пирамидотомии у
взрослых крыс, полностью исчезает после предварительно произведенной перерезки
кортикоспинального тракта.
При компенсации
двигательных и поведенческих нарушений после пирамидотомии наиболее вероятным
образованием, участвующим в ликвидации пирамидного дефицита, является
кортико-руброспинальная система, что во многом определяется большим сходством
структурных и функциональных особенностей этих двух нисходящих
систем. Дефицит, вызванный одной из этих двух систем, является преходящим,
и функциональное восстановление осуществляется как результат способности
неповрежденной системы брать на себя контроль за движением. Ведущим
фактором в описанном феномене является взаимовлияние кортикоспинальной и
кортико-руброспинальной систем, их свойство взаимозамещаемости, являющееся
уникальным среди всех нисходящих двигательных систем. Важно отметить, что
переключающее действие рубро-оливарной проекции может осуществляться в обоих
направлениях, и в случае повреждения кортикоспинальной системы в компенсацию
возникающих расстройств включается кортико-руброспинальная система. Общим
свойством описанных выше моделей является то, что предварительное повреждение
периферической части системы, представленной нисходящей спинальной проекцией
(кортикоспинальной или руброспинальной), облегчает компенсацию центрального
звена при его последующем повреждении.
1. Cheney P. D., Mewes K., Fetz
E. E. - Behav. Brain Res. 1988. V. 28. P. 181-191.
2. Hepp-Reymond M. C.,
Wiesendanger M. - Brain Res. 1972. V. 36. P. 117-131.
3. Ten-Donkelaar H. T. - Behav. Brain Res. 1988. V. 28. P. 9-20.
4. Kennedy P. R. - Trends Neurosci. 1990. V. 13. P. 474-479.
5. Kennedy P. R., Humphry D. R.
- Neurosci. Res. 1987. V. 5. P. 39-62.
6. Фанарджян В. В., Папоян Е.
В., Геворкян О. В., Погосян В. И. - Журн. высшей нервной
деятельности. 1993. Т. 43. С. 1210-1217.
7. Fanardjian V. V., Papoyan E. V., Pogossian V. I., Gevorkyan O. V.
- Neural Plasticity. 1999. V. 6. P. 123-131.
8. Fanardjian V. V., Papoyan E.
V., Hovhannisyan E. A., Melik-Moussian A. B., Gevorkyan O. V., Pogossian V. I. -
Neuroscience. 2000. V. 98. P. 385-395.
9. Paxinos G., Watson Ch. -
The Rat Brain in Stereotaxic Coordinates. 2nd edn.
Sydney: Academic Press, 1986.
10. Hicks S. P., D'Amato C. J. - Exp. Neurol. 1977. V 56.
P 410-420.