МОЛЕКУЛЯРНАЯ БИОЛОГИЯ
УДК 577.125
А. З. Пепоян
Особенности фосфолипидного состава некоторых
штаммов
E.coli из кишечной микрофлоры человека
(Представлено академиком К. Г. Карагезяном 27/VI 2000)
По имеющимся в литературе данным, некоторые
бактерии кишечной флоры обладают канцеролитическими свойствами [1]. С
другой стороны, к настоящему времени установлено, что при патологических
состояниях организма, в частности при злокачественном росте, изменяются состав и
метаболизм фосфолипидов (ФЛ), что приводит к нарушению структуры и функции
клеток [2, 3]. Ранее нами было показано, что некоторые штаммы
E.coli (G-35 N 59; 60; 61), характерные для нормальной
микрофлоры кишечника человека, способны вызывать некроз раковых клеток in
vitro. Штаммы, выделенные от онкологических больных, не обладали такими
свойствами [4].
Целью настоящей работы было
изучение качественного и количественного состава ФЛ и особенностей пероксидации
липидов клеток E.coli из кишечной микрофлоры людей.
В экспериментах использованы три штамма бактериальных клеток
E.coli G-35 N 59; 60; 61, зарегистрированных в
Государственном научно-исследовательном институте стандартизации и контроля
медицинских и биологических препаратов им. Л. А. Тарасевича
(паспорт N 01-07/89, 22.03.83 г.) и депонированных в банке культур США
.
Поскольку интенсивное липидообразование
происходит после завершения активного роста культуры в период стационарной фазы
[5] и липиды грамотрицательных бактерий сосредоточены в основном в клеточной
оболочке [6], для определения ФЛ-состава были использованы суточные культуры.
Ввиду того, что в стенках и мембранах
бактерий количество ФЛ с высоконасыщенными жирнокислотными остатками, а также
гликолипидов мало [7, 8], для исследования ФЛ-состава был использован метод
Фольча [9] в модификации [10, 11].
Для
проверки достоверности полученных данных был использован статистический метод
Стьюарда - Фишера.
В таблице представлены
качественный и количественный состав фосфолипидов клеток E.coli, характерных для
кишечной микрофлоры человека.
Состав фосфолипидов клеточных стенок и цитоплазматических
мембран штаммов E.coli из кишечной микрофлоры людей
| |
Клетки |
E.coli G-35 N59, |
E.coli G-35 N60, |
E.coli G-35 N61 |
E.coli от |
|
|
от здорового |
от здорового |
от здорового |
больного ра- |
|
ФЛ |
|
человека |
человека |
человека |
ком человека |
|
|
| Лизофосфати- |
1.4 |
1.5 |
1.4 |
2.5 |
| дилхолины (182)* |
|
|
|
|
| Сфингомие- |
2.5 |
2.7 |
2.6 |
4.6 |
| лины (183) |
|
|
|
|
| Фосфатидил- |
8.1 |
5.4 |
6.7 |
11.6 |
| серины (183) |
|
|
|
|
| Фосфатидили- |
16.1 |
7.8 |
8.1 |
9.1 |
| нозиты (258) |
|
|
|
|
| Фосфатидил- |
10.7 |
25.9 |
20.3 |
8.3 |
| холины (182) |
|
|
|
|
| Фосфатидилэта- |
25.5 |
30.2 |
27.4 |
35.7 |
| ноламины (129) |
|
|
|
|
| Фосфатидилгли- |
25.2 |
15.5 |
23.3 |
16.8 |
| церины (170) |
|
|
|
|
| Кардиоли- |
23.7 |
10.7 |
10.2 |
11.4 |
| пины (220) |
|
|
|
|
* В скобках приведены молекулярные массы полярных головок индивидуальных
фосфолипидов.
Основываясь на приведенных данных,
попытаемся выяснить характер функции распределения ФЛ в клеточных стенках и
цитоплазматических мембранах исследуемых клеток.
Обозначим массу ФЛ типа i в мембране через gi; его доля в
мембране будет описываться соотношением
где
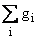 - суммарная масса всех ФЛ в
мембране.
- суммарная масса всех ФЛ в
мембране.
Учитывая молекулярные массы
полярных головок ФЛ (таблица), вычислены значения 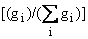 для
ФЛ E.coli здорового человека
и больного раком человека.
для
ФЛ E.coli здорового человека
и больного раком человека.
Распределение ФЛ
в клеточных стенках и цитоплазматических мембранах исследуемых E.coli в основном
имеет бимодальный характер и состоит из двух (низкомолекулярной и
высокомолекулярной) фракций. При этом в мембранах E.coli, характерных для
больного раком человека, имеет место значительное увеличение концентрации ФЛ с
малыми размерами полярных головок. В клеточных мембранах E.coli больного
раком человека увеличивается средний отрицательный заряд молекул ФЛ.
В грамотрицательных бактериях основными ФЛ
являются фосфатидилэтаноламины (ФЭ) [12, 13]. Как видно из таблицы, в
клетках E.coli, полученных от больного раком человека, концентрация ФЭ увеличена
по сравнению с E.coli здорового человека.
Другим важным ФЛ, имеющим существенное значение для стабилизации
структуры мембран бактериальных клеток, является фосфатидилхолин (ФХ)
[13]. Известно, что ФХ в присутствии воды спонтанно может образовывать
стабильные бимолекулярные слои в широких диапазонах концентраций ионов и
температур. При этом ФХ в смеси с другими ФЛ способствует образованию
бимолекулярных слоев. Интересно отметить, что ФХ взаимодействует с гидрофобными
анионами сильнее, чем ФЭ, что может иметь большое значение для адсорбции и
связывания биологически важных веществ с поверхностью клеточной мембраны.
Как видно из таблицы, по сравнению с E.coli,
характерными для здоровых людей, в мембранах E.coli больного раком имеет место
резкое уменьшение концентрации ФХ. Уменьшение процентного содержания ФХ в
этих штаммах приводит к изменению отношения ФХ/ФЭ, что может влиять на вязкость
липидной фракции клеточных стенок.
Среди
функционально важных липидов большое значение имеют ФЛ, несущие на полярной
группе отрицательный заряд. Именно наличие таких ФЛ обеспечивает в
определенной мере жидкую структуру мембраны. Электростатическое
отталкивание отрицательно заряженных групп молекул ФЛ должно обеспечивать
"жидкую" структуру мембраны.
Из таблицы
явствует, что в мембранах E.coli больного раком человека значительно
увеличивается концентрация фосфатидилсеринов. Изменение процентного
содержания кислых ФЛ в этих клетках на фоне относительно стабильного содержания
нейтральных ФХ и ФЭ может приводить к изменению степени ионизации их
мембран. В исследуемых клетках обнаружены лизофосфатидилхолины
(ЛФХ). Известно, что окисленные формы ФЛ способствуют дестабилизации
мембранной структуры. Являясь более полярными, они легче выходят из
мембраны и тем самым способствуют обновлению их состава. Результаты
экспериментов свидетельствуют о том, что помимо уменьшения количества ФХ в
клетках E.coli, выделенных от больных раком людей, наблюдается увеличение
процентного содержания ЛФХ.
Обнаруженные
нами изменения в ФЛ - ФЛ соотношениях клеточных мембран штаммов E.coli дают
возможность предположить, что мембраны E.coli больных раком людей являются более
устойчивыми к полиионам, в частности к ионам Ca++, и обладают
значительно меньшей устойчивостью структуры, чем мембраны штаммов E.coli,
выделенных от здоровых людей.
Таким образом,
выявлен фосфолипидный состав штаммов E.coli G-35 N
59; 60; 61, характерных для нормальной микрофлоры человека.
Институт молекулярной биологии
НАН РА
Литература
1. Caygill С. Р.,
Braddik M., Hill M. J., Knowless R. L., Sharp J. C. - Eur. Cancer
Prev. 1995. V. 4. P. 187-93.
2. Hatala M. A., Rayburn J., Rose D. P. - Lipids. 1994.
V. 29. Р. 831.
3. Subramanian S., Gagadeeson M., Devi C. S. - Chemo therapy.
1994. V. 40. P. 427-30.
4. Карапетян A. O. Биологический антагонизм некоторых
представителей кишечной микрофлоры и опухолевых
клеток. Kанд. дис. М.: 1987. 101 с.
5.
Скрябин T. K., Еремин. В. К., Боронин А.. М. и др.
В сб.: Проблемы биохимии и физиологии
микроорганизмов. Пущино, 1985. С. 308.
6. Ивков В. Г., Берестовский Г.
Н. Липидный бислой биологических мембран. М.: Наука, 1982.
244 с.
7. Rock C. O., Cronon J.
E. In: Biochemistry of lipids and membranes
/D. E. Vance. Eds. Ine. Menlo Park, California, The
Benjamin/publishing company, 1985. P. 73-115.
8. Громов Б. В.,
Павленко Г. В. Экология бактерий. Л.: ЛГУ,
1989. 248 с.
9. Folch
G. М., Lees G., Stone J. - Biol. Chem., 1957.
V. 226. P. 497.
10. Карагезян К. Г. Фосфолипиды и их роль в
жизнедеятельности организма. Ереван: Айастан 1972. 267 с.
11. Пепоян A. З., Кцоян Ж. А.,
Шагинян А. А., Осипян Л. Н., Карагезян К. Г. - Биофизика. 1991.
Т. 36. С. 475-479.
12. P. F. Devaux. - Biochem. Biophys. Асtа. 1985.
V. 882. Р. 222.
13. Бирюзова Ж. И. Мембранные структуры микроорганизмов.
М.: Наука, 1973. 136 с.
14. Бурлакова Е. Б. Биохимия липидов и их роль в обмене
веществ. М.: Наука, 1981.
![]() - суммарная масса всех ФЛ в
мембране.
- суммарная масса всех ФЛ в
мембране. ![]() для
ФЛ E.coli здорового человека
и больного раком человека.
для
ФЛ E.coli здорового человека
и больного раком человека.