УДК 577.1527277:612.8.015
Регуляторное влияние пептидов гипоталамуса на процессы
посттрансляционной модификации белков синаптических
мембран
мозга
(Представлено 23/XI 1999)
Ранее нами из растворимой фракции гипоталамуса крупного рогатого скота были выделены пептиды и ряд белков, которые являются первичными активаторами Ca2+-кальмодулин-зависимых ферментов-фосфодиэстеразы циклических нуклеотидов, киназы легких цепей миозина(цАМФ ФДЭ, КЛЦМ и т.д.), так как в концентрациях 10-12-10-9M активируют вышеуказанные ферменты без участия ионов кальция и кальмодулина(CaM). Удалось расшифровать их полную первичную структуру [1]. Ими оказались тимозин b4 (1-39), или C-модулин 3, который согласно литературным данным принимает участие в механизмах межклеточной сигнализации, иммунитета и эндокринной регуляции [2], и дипептид Arg-Phe (RF), который повышает в 2-3 раза уровень норадреналина, стимулируя симпатические нервные окончания [3]. Таким образом, впервые были открыты фундаментальные биохимические механизмы действия тимозинов (Tb4, 1-39, Tb9).
|
|
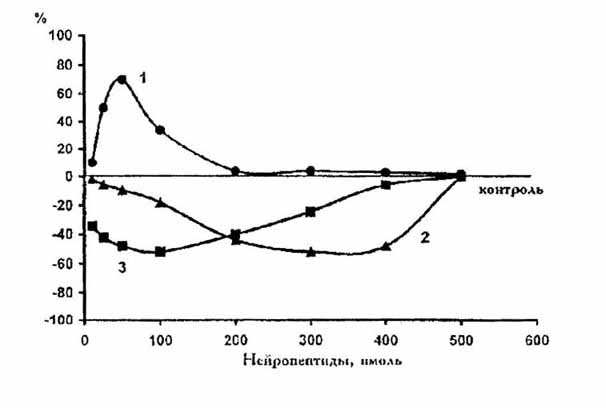
Дозозависимое изменение включения меченых АДФ-рибозильных
остатков в акцепторные
На рисунке представлены кривые доза-эффект при содержании
в пробе 50-100 нмоль исследуемых нейропептидов. Дипептид и нонапептид,
содержащий 5 остатков лизина, подавляют эндогенное АДФ-рибозилирование,
причем максимальное ингибирование до 50% достигалось при добавлении в пробу
300 нмоль дипептида или 100 нмоль нонапептида. В отличие от них гептапептид,
содержащий лишь 2 остатка лизина, стимулировал АДФ-рибозилирование, повышая
включение метки до 66% при 50 нмоль в пробе. Ингибирование эндогенного
АДФ-рибозилирования дипептидом, возможно, связано с тем, что последний
содержит остаток аргинина, а значит, может служить субстратом для аргинин-специфической
АДФ-рибозилтрансферазы и конкурировать с акцепторными белками СМ. Нонапептид
не содержит акцепторных аминокислот для моноАДФ-рибозилтрансферазы, но
его 5 остатков лизина - акцепторы для полиАДФ-рибозилирования. Гептапептид,
содержащий лишь два остатка лизина, оказывает на общее эндогенное АДФ-рибозилирование
противоположное действие.
Институт биохимии им. Г.Х. Бунятяна НАН РА
Литература 1.Galoyan A.A. Biochemistry of
Novel Cardioactive Hormones and Immunomodulators of the Functional System
Neurosecretory Hypothalamus- Endocrine Heart. Moscow: Nauka Publishers,
1997.
белки синаптических мембран церебрального кортекса
крыс под влиянием нейропептидов (1 - гептапептид, 2 - нонапептид, 3 - дипептид).
По оси абсцисс - содержание в пробе пептидов в нмоль, по оси ординат -
эндогенное АДФ-рибозилирование белков СМ в процентах по отношению к контролю
(n=6. p < 0,05, M±m).
Выявленное нами дозозависимое разнонаправленное
действие гипоталамических нейропептидов на эндогенное АДФ-рибозилирование
белков синаптических мембран клеток мозга указывает на возможные молекулярные
механизмы их влияния на синаптические процессы. Воздействуя на полиАДФ-рибозилирование,
они могут влиять также на пролиферацию и дифференциацию иммуннокомпетентных
T-лимфоцитов
[9]. Влияя же на моноАДФ-рибозилирование, нейропептиды могут регулировать
концентрацию внутриклеточного кальция, так как аргинин- и цистеин-специфические
АДФ-рибозилтрансферазы, взаимодействуя с G-белками, влияют на проведение
внешних сигналов от рецепторов к таким эффекторным системам, как аденилатциклаза,
фосфолипазы C, A2 и D, а также ионные каналы
[10], кроме того моноАДФ-рибозилирование ингибирует глицеральдегид-3-фосфатдегидрогеназу,
подавляя самосборку триад в саркоплазматическом ретикулуме и выброс Ca2+[11],
понижает уровень Ca2+ в диплоидных фибробластах человека
[10].
По мнению А.А. Галояна, действие гипоталамических
пептидов реализуется через сложный механизм взаимовлияния последних в системе
актин-актомиозин, а также активирования процессов посттрансляционной модификации
- эндогенного АДФ-рибозилирование. Дальнейшие исследования прольют свет
на реципрокную связь Ca2+-зависимых и Ca2+-независимых
путей регуляции внутриклеточных процессов, лежащих в основе важнейших физиологических
реакций организма.
2.Safer D., Erlinga M., Nachimas
V.T. - J. Biol. Chem. 1991. V. 266. № 7. P. 4029-4039.
3.Thiemerman C., Al-Damluji
S., Hecker M., Vane J.R. - Biochem. Biophys. Res. Commun. 1990. V. 172.
№ 3. P. 705-708.
4.Галоян А.А., Бабрускин И.Д.,
Гурвиц Б.Я., Абрамян Г.Е. - Нейрохимия. 1989. Т. 8. № 1. С. 78-86.
5.Tsuchiya M., Tanigawa Y.,
Ushiroyama T., Matsuura R., Shimoyama M. - Eur. J. Biochem. 1990.
V. 147. № 1. P. 33-40.
6.Just I., Geipel H., Wegner
A., Actories K. - Eur. J. Biochem. 1990. V. 192. № 5. P. 723-727.
7.Мовсесян Н.О., Бурназян Л.Б.,
Арутюнян А.В. - Нейрохимия. 1992. Т. 11. № 1. С. 41-47.
8.Bradford M.M. - Anal. Biochem.
1976. V. 72. № 2. P. 248-254.
9.Spagelo B.L. - Front Neuroendocrinology,
1987. V. 16. № 1. P. 122.
10.Ui M. In: ADP-ribose transfer
reaction/ Ed. Jacobson M.K., Jacobson E.L. New York: Springer-Verlag, 1989.
P. 386-389, 414-457.
11.Dimmler S., Lottspeich F.,
Brune B. - J. Biol. Chem. 1992. V. 267. № 24. P. 16771-16774.